Van der Waals-erők
(diszperziós erők)
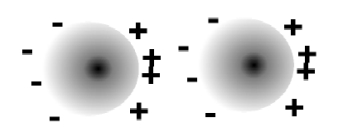 A molekulák közötti kapcsolatot létrehozó
erők között fontosak az úgynevezett Van der Waals-féle erők. Ezek intenzitása
viszonylag gyengébb (általában egy nagyságrenddel kisebb, mint az atomokat
egyesítő erők és ideiglenes, laza kapcsolatot hoznak létre a szomszédos molekulák,
illetve atomok között. Fordítottan arányosak az atomok vagy molekulák közötti távolság hetedik hatványával. A Van der Waals-féle
erők úgy jönnek létre, hogy az elektromos szempontból telített molekulákban
lévő atomok pozitív magjai
és negatív elektronjai között, még
bizonyos, a töltési-súlypontok helyzetbeli különbségei által kiváltott vonzási
erők (dipóluserők) indulnak ki a szomszédos molekulák
atomjainak elektronhéjai
irányába. Ebben az esetben tehát úgynevezett intermolekuláris erőkről van szó.
A molekulák közötti kapcsolatot létrehozó
erők között fontosak az úgynevezett Van der Waals-féle erők. Ezek intenzitása
viszonylag gyengébb (általában egy nagyságrenddel kisebb, mint az atomokat
egyesítő erők és ideiglenes, laza kapcsolatot hoznak létre a szomszédos molekulák,
illetve atomok között. Fordítottan arányosak az atomok vagy molekulák közötti távolság hetedik hatványával. A Van der Waals-féle
erők úgy jönnek létre, hogy az elektromos szempontból telített molekulákban
lévő atomok pozitív magjai
és negatív elektronjai között, még
bizonyos, a töltési-súlypontok helyzetbeli különbségei által kiváltott vonzási
erők (dipóluserők) indulnak ki a szomszédos molekulák
atomjainak elektronhéjai
irányába. Ebben az esetben tehát úgynevezett intermolekuláris erőkről van szó.
A Van der Waals-féle erők egyaránt hatnak gázhalmazállapotú, folyékony
és szilárd anyagok molekulái között.
A csepfolyósított és megfagyasztott nemesgázok
atomjait például csak a Van der Waals-féle
erők tartják össze, minthogy a komplett elektronhéjak
(oktett) létezése következtében kémiai természetű vonzóerőkről nem lehet szó.
Ezek az erők a felelősek a van der Waals egyenletben az A/V2 kifejezésért.
Ezek az erők, okozzák a gázok ideálistól eltérő viselkedését és a molekularácsos kristályok rácsenergiáját.
Háromféle kölcsönhatás eredményeként jönnek létre:
(1) dipól-dipól kölcsönhatás, azaz elektrosztatikus vonzás két állandó dipólusmomentummal rendelkező molekula között;
(2) dipólus-indukált dipólus kölcsönhatás, amelyben az egyik molekula dipólusa polarizálja a szomszédos molekulát;
(3) diszperziós erők, amelyek az atomok kis, pillanatszerű dipólusából származnak.
Felhasznált irodalom
 A molekulák közötti kapcsolatot létrehozó
erők között fontosak az úgynevezett Van der Waals-féle erők. Ezek intenzitása
viszonylag gyengébb (általában egy nagyságrenddel kisebb, mint az atomokat
egyesítő erők és ideiglenes, laza kapcsolatot hoznak létre a szomszédos molekulák,
illetve atomok között. Fordítottan arányosak az atomok vagy molekulák közötti távolság hetedik hatványával. A Van der Waals-féle
erők úgy jönnek létre, hogy az elektromos szempontból telített molekulákban
lévő atomok pozitív magjai
és negatív elektronjai között, még
bizonyos, a töltési-súlypontok helyzetbeli különbségei által kiváltott vonzási
erők (dipóluserők) indulnak ki a szomszédos molekulák
atomjainak elektronhéjai
irányába. Ebben az esetben tehát úgynevezett intermolekuláris erőkről van szó.
A molekulák közötti kapcsolatot létrehozó
erők között fontosak az úgynevezett Van der Waals-féle erők. Ezek intenzitása
viszonylag gyengébb (általában egy nagyságrenddel kisebb, mint az atomokat
egyesítő erők és ideiglenes, laza kapcsolatot hoznak létre a szomszédos molekulák,
illetve atomok között. Fordítottan arányosak az atomok vagy molekulák közötti távolság hetedik hatványával. A Van der Waals-féle
erők úgy jönnek létre, hogy az elektromos szempontból telített molekulákban
lévő atomok pozitív magjai
és negatív elektronjai között, még
bizonyos, a töltési-súlypontok helyzetbeli különbségei által kiváltott vonzási
erők (dipóluserők) indulnak ki a szomszédos molekulák
atomjainak elektronhéjai
irányába. Ebben az esetben tehát úgynevezett intermolekuláris erőkről van szó.