sav
(savas hidrogén, savmaradék, egyértékű, egybázisú, egybázisos, kétértékű, kétbázisú, kétbázisos, háromértékű, hárombázisú, három bázisú, erős sav, gyenge sav, oxisav, oxigénmentes sav, savanhidrid, ásványi savak, biner sav, hidrogénsav, vizes sav)
Nemfémek és félfémek oxidjai vízzel savakat
alkotnak.
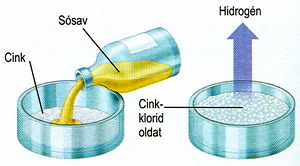 A savak
olyan vegyületek, amelyeknek helyettesíthető
hidrogénatomja(i)
van(nak) (savas hidrogén - amely(ek) a sav disszociációjakor pozitív iont képez(nek)),
vizes oldatuk vezeti az elektromos áramot,
annál jobban, minél erősebb sav. Sav minden olyan vegyület, amely
hidrogéniont tud leadni. A savak oldata a legtöbb fémet
hidrogén keletkezése
közben feloldja (ábra) és sok vegyület,
pl. színezék (indikátor) színét megváltoztatja,
pl. a lakmusz oldatát pirosra, a kurkuma nevü sárga színezéket barnára, stb.
A savak
olyan vegyületek, amelyeknek helyettesíthető
hidrogénatomja(i)
van(nak) (savas hidrogén - amely(ek) a sav disszociációjakor pozitív iont képez(nek)),
vizes oldatuk vezeti az elektromos áramot,
annál jobban, minél erősebb sav. Sav minden olyan vegyület, amely
hidrogéniont tud leadni. A savak oldata a legtöbb fémet
hidrogén keletkezése
közben feloldja (ábra) és sok vegyület,
pl. színezék (indikátor) színét megváltoztatja,
pl. a lakmusz oldatát pirosra, a kurkuma nevü sárga színezéket barnára, stb.
A savak vízben és és bizonyos más oldószerekben oldva hidrogénre
és savmaradékra disszociálnak, a hidrogén
az oldatban pozitív töltésű ion
(kation), a savmaradék pedig negatív
töltésű ion
(anion) formájában van jelen.
Néhány jellemző példa: sósav (HCl),
anionja a Cl- (kloridion),
salétromsav (HNO3), anionja
a NO3- (nitrátion), a szénsav (H2CO3),
anionja a CO32-
(karbonát-ion), a kénsav (H2SO4),
anionja a SO42-
(szulfátion).
A savak helyettesíthető hidrogénjeinek számát a sav "(vegy)értékének"
nevezzük, tehát a sósav pl. egy (vegy)értékű,
a kénsav két (vegy)értékű sav.
Említik az egybázisú (egybázisos), kétbázisú (kétbázisos),
hárombázisú (hárombázisos) kifejezést is ugyanerre.
A savak különböző erősségüek, de ez nem függ össze (vegy)értékükkel
Az erős savak, mint pl. sósav
, vizes oldatában teljesen disszociálnak.
A gyenge savak, mint pl. a szénsav
vizes oldatában csak részlegesen disszociálnak.
Az oxisavak (Oxigént
tartalmazó savak) alapját képező oxidokat
savanhidrideknek (anhidrid=víztől
megfosztott) nevezzük. Pl. a szén-dioxid
(CO2) a szénsav savanhidridje.
Oxigénmentes
savak, pl. a sósav esetén természetesen
nem beszélhetünk savanhidridről.
Ásványi savaknak az erős szervetlen
savakat (pl. salétromsav, kénsav)
nevezik.
A biner savak olyan savak, amelyben a savas hidrogénatom(ok) nem oxigénhez,
hanem közvetlenül más atomhoz kapcsolódnak.
Például a sósav
(HCl).
Az ilyen vegyületeket néha hidrogénsavaknak nevezik.
A vizes savakban a savas hidrogén egy fémionhoz kapcsolódó vízmolekulán helyezkedik el.
Például
Al(OH2)63+ + H2O → Al(OH2)5)(OH)2+ + H3O+
A savasság és lúgosság mértékét a pH értékkel
fejezik ki.
A lexikonomban található összes sav, illetve oxisav legyűjthető
a Szójegyzék keresőmezőjébe a sav illetve oxisav keresőszót beírva.
Felhasznált irodalom
 A savak
olyan vegyületek, amelyeknek helyettesíthető
hidrogénatomja(i)
van(nak) (savas hidrogén - amely(ek) a sav disszociációjakor pozitív iont képez(nek)),
vizes oldatuk vezeti az elektromos áramot,
annál jobban, minél erősebb sav. Sav minden olyan vegyület, amely
hidrogéniont tud leadni. A savak oldata a legtöbb fémet
hidrogén keletkezése
közben feloldja (ábra) és sok vegyület,
pl. színezék (indikátor) színét megváltoztatja,
pl. a lakmusz oldatát pirosra, a kurkuma nevü sárga színezéket barnára, stb.
A savak
olyan vegyületek, amelyeknek helyettesíthető
hidrogénatomja(i)
van(nak) (savas hidrogén - amely(ek) a sav disszociációjakor pozitív iont képez(nek)),
vizes oldatuk vezeti az elektromos áramot,
annál jobban, minél erősebb sav. Sav minden olyan vegyület, amely
hidrogéniont tud leadni. A savak oldata a legtöbb fémet
hidrogén keletkezése
közben feloldja (ábra) és sok vegyület,
pl. színezék (indikátor) színét megváltoztatja,
pl. a lakmusz oldatát pirosra, a kurkuma nevü sárga színezéket barnára, stb.