ionrács
(ionvegyület, ionos vegyület)
 Az ionrácsok,
illetve az azokat alkotó ionvegyületek folyékony állapotban vagy alkalmas
oldószerben feloldva elektrolitok. Ionjaik
lehetnek egyszerűek, mint például a kationok
közül a Na+, Ca2+, Al3+, stb, illetve az anionok
közül a F-, Cl-, O2-, stb. Gyakoriak az összetett
ionok is, mint például a kationok közül
az NH4+, amely egészen úgy viselkedik, mint az az alkálifémkationok,
vagy az anionok közül a SO42-,
NO3-, CO32-, stb.
Az ionrácsok,
illetve az azokat alkotó ionvegyületek folyékony állapotban vagy alkalmas
oldószerben feloldva elektrolitok. Ionjaik
lehetnek egyszerűek, mint például a kationok
közül a Na+, Ca2+, Al3+, stb, illetve az anionok
közül a F-, Cl-, O2-, stb. Gyakoriak az összetett
ionok is, mint például a kationok közül
az NH4+, amely egészen úgy viselkedik, mint az az alkálifémkationok,
vagy az anionok közül a SO42-,
NO3-, CO32-, stb.
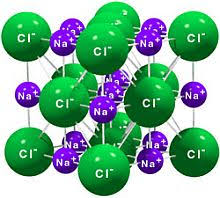
Az ábrán a nátrium-klorid ionrácsa
látható.
Az elemi ionok gömbalakúak, az összetettek
közül vannak egy síkban elhelyezkedők, tetraéder alakúak, stb.
Az ionok a rácsban egyensúlyi helyzetük
közül rezegnek a hőmérséklettől függően
egyre nagyobb mértékben, akár a rácstávolság 30%-át is elérően. A hőmérséklet
további növelésével a kristályrács
megolvad. A folyadékrészecskék
szabad úthossza már sokkal kisebb,
és pontos elrendezkedésükre csak elméletek vannak.
Gőzállapotban az ionrácsok
ionmolekulákra oszlanak, pl. a kősó elpárolgásakor
az elektrosztatikus erők által összetartott
Na+Cl- molekulákból
álló gőz keletkezik, de vannak asszociált
(Na+Cl-)2, stb. molekulák
is a gázban.
Az ionrácsok fénytörése az egyes ionok
fénytöréséből adódik össze. Olvadáspontjuk
általában magas, forráspontjuk méginkább,
és a kettő között jelentős különbség van. Vízben és más ionizáló oldószerekben,
sok ionos anyag oldódik, de az egynél több vegyértékű
ionokból álló ionrácsok általában
rosszabbul oldódnak.
Felhasznált irodalom
 Az ionrácsok,
illetve az azokat alkotó ionvegyületek folyékony állapotban vagy alkalmas
oldószerben feloldva elektrolitok. Ionjaik
lehetnek egyszerűek, mint például a kationok
közül a Na+, Ca2+, Al3+, stb, illetve az anionok
közül a F-, Cl-, O2-, stb. Gyakoriak az összetett
ionok is, mint például a kationok közül
az NH4+, amely egészen úgy viselkedik, mint az az alkálifémkationok,
vagy az anionok közül a SO42-,
NO3-, CO32-, stb.
Az ionrácsok,
illetve az azokat alkotó ionvegyületek folyékony állapotban vagy alkalmas
oldószerben feloldva elektrolitok. Ionjaik
lehetnek egyszerűek, mint például a kationok
közül a Na+, Ca2+, Al3+, stb, illetve az anionok
közül a F-, Cl-, O2-, stb. Gyakoriak az összetett
ionok is, mint például a kationok közül
az NH4+, amely egészen úgy viselkedik, mint az az alkálifémkationok,
vagy az anionok közül a SO42-,
NO3-, CO32-, stb. 