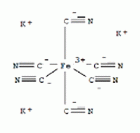
 K3Fe(CN)6
K3Fe(CN)6
ferricianid / ferrocianid
(hexaciano-ferrát (III), kálium-ferricianid, vörösvérlúgsó,
hexaciano-ferrát (II), kálium-ferrocianid, sárgavérlúgsó, kékderítés, E536)
 K3Fe(CN)6
K3Fe(CN)6
hexaciano-ferrát (III) /[Fe(CN)6]3-/
kálium-ferricianid, vörösvérlúgsó
 Fizikai és kémiai tulajdonságok
Fizikai és kémiai tulajdonságok
Piros, kristályos por.
Sűrűsége (kristályvizes)
1,89 g/cm3
Olvadáspontja (kristályvizes)
300 °C
Vízben oldódik
(46 g/100 ml, 20°C-on)
Melegítve elbomlik mérgező gázokat (hidrogén-cianid)
fejlesztve.
Savakkal cianidokat képezve reagál
Felhasználás
Laboratóriumi vegyszerként.
A fényképészetben (az ezüstionok eltávolítására).
Biológia
Enyhén irritálja a szemet, a bőrt és a légzőrendszert.
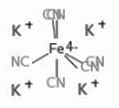 K4Fe(CN)6
K4Fe(CN)6
hexaciano-ferrát (II) /[Fe(CN)6]4-/
kálium-ferrocianid, sárgavérlúgsó
 Fizikai
és kémiai tulajdonságok
Fizikai
és kémiai tulajdonságok
Vízmentes állapotban fehér
por, 3 kristályvízzel sárga kristályokat
alkot.
Sűrűsége (kristályvizes)
1,85 g/cm3
Olvadáspontja (kristályvizes)
kb. 70 °C
Vízben oldódik
(28,9 g/100 ml, 20°C-on)
Melegítve 400°C körül elbomlik mérgező
gázokat (hidrogén-cianid) fejlesztve,
előtte 100°C-on elveszti kristályvizét.
Egymással és további vasionokkal
különféle kék színű csapadékokat alkotnak,
pl. berlini kéket (Fe4[Fe(CN)6]3) vagy Turnbull-kéket
(Fe3[Fe(CN)6]2). Ezeket színezékként használják.
Savakkal cianidokat
képezve reagál.
Előállítás
Vas(II)-sók és kálium-cianid reakciójával, vizes oldatban:
FeSO4 + 6 KCN -> K4[Fe(CN)6] + K2SO4
Felhasználás
Laboratóriumi vegyszerként.
A fényképészetben.
Bor derítésére (kékderítés) a gombaölő rézvegyületek eltávolítására.
(Körültekintést igénylő művelet, mivel a borban található savak hatására a felesleg
cián-hidrogénre bomolhat.)
Konyhasóhoz csomósodást gátló adalékként.
Élelmiszeradalékként kódja E536.
Biológia
Lenyelve vagy bőrrel érintkezve irritációt okozhat.
Napi megengedett maximum beviteli mennyisége 25 mg/testsúlykg.
Az élelmiszerekben használt mennyiségek esetén nincs ismert mellékhatása.
A halálos dózisa (LD50) patkányokon 6400 mg/kg.