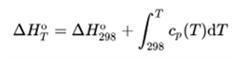
entalpia
A termodinamikában gyakran használt
energia jellegű mennyiség.
Jele H
Mértékegysége: J (joule)
Definíciója: H = U+ pV
ahol U a belső energia, p a nyomás,
V a térfogat.
Ha egy gáz hőmérsékletét
állandó nyomáson növeljük, akkor az ehhez
szükséges hő megegyezik a gáz belső
energiájának növekedésével, valamint a külső nyomás
ellenében végzett munkával, ez az összeg
pedig éppen a gáz entalpiájának megváltozása.
Az entalpiának abszolút zérus pontja (a belső
energiához hasonlóan) nincs, így csak változása mérhető.

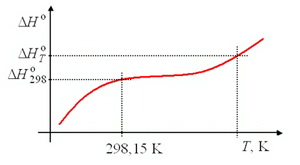
A képződési entalpia hőmérsékletfüggése
Az energiamegmaradás törvénye és a Hess-törvény alapján a vegyületek standard
képződési entalpiája kiszámítható a reakcióegyenlet szerint, és számítható más
hőmérsékletre a hőkapacitás hőmérsékletfüggvényének integrálásával (összenyomhatatlan
anyagot feltételezve: