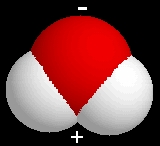
 A vízmolekula
negatív töltésű része az oxigén
atomnál (felül), pozitív töltésű része
a hidrogén atomok között (alul) látható az ábrán.
A vízmolekula
negatív töltésű része az oxigén
atomnál (felül), pozitív töltésű része
a hidrogén atomok között (alul) látható az ábrán. dipólus
(dipólusmomentum, dipólusnyomaték, poláris molekula, nem poláris vegyület, apoláris, apoláros)
Elkülönített, ellentétes elektromos töltéspár.
A dipólusmomentum/dipólusnyomaték (jele μ) a pozitív töltés és a töltések közti távolság szorzata.
A dipólusmomentumot gyakran fejezik ki debye-ban; az SI egysége coulomb méter.
Egy kétatomos molekulában, pl. a HCl-ben a dipólusmomentum a kötés poláris jellegének a mértéke (poláris molekula); azaz az átlagos elektrontöltés eltolódása valamelyik atom felé.
Egy többatomos molekulában a dipólusmomentum az egyes kötések dipólusmomentumainak vektoriális összege.
Szimmetrikus molekulában, például a tetreklórmetánban (CCl4), nincs eredendő dipólusmomentum, noha az egyes C-Cl kötések polárisak.
A molekulákat polaritásuk alapján két csoportba sorolhatjuk:
Apolárisak (apolárosak)
- ha a molekula kötései
apolárisak (ilyen pl. a hidrogén
molekulája H-H -> H2
- ha a kötései polárisak, de
a kötések szimmetrikus elrendeződése
folytán a polaritásvektorok összegzése nullát ad (ilyen pl a szén-dioxid
O=C=O /CO2/)
Azok a vegyületek, amelyek permanens dipólus momentummal nem rendelkező kovalens molekulákat tartalmaznak nem poláris vegyületek (pl. metán vagy benzol)
Dipólusosak
- ha a kötéseik polárisak és a kötések elrendeződése asszimetrikus
A molekulán belül a töltések eloszlása
a meghatározó.
A kétatomos molekulák dipólusossá
válnak, ha az atomoknak különböző mértékű
az elektronegativitásuk; az elektronegatívabb atom
részlegesen negatív töltésű lesz. (Ilyen
pl. a sósav H-Cl -> HCl molekulája.)
A több atomból álló molekulákban
a dipólusok vektorszerűen összeadódnak, így pl. a nem lineáris
víz (H2O) molekula
dipólusos, de az egyenes szén-dioxid
/CO2 (O=C=O)/ kvadrupol, a tetraéderes metánmolekula /CH4 pedig oktupol.
 A vízmolekula
negatív töltésű része az oxigén
atomnál (felül), pozitív töltésű része
a hidrogén atomok között (alul) látható az ábrán.
A vízmolekula
negatív töltésű része az oxigén
atomnál (felül), pozitív töltésű része
a hidrogén atomok között (alul) látható az ábrán.