abszorpció (kémia)
(abszorpciós együttható, abszorpciókoefficiens)
A kémiában a gázok oldódása folyadékokban
vagy szilárd testekben.
Az oldhatóság függ a hőmérséklettől. Ez figyelhető meg a víz melegítésekor,
amikor a forráspont elérése előtt apró levegő buborékok szállnak fel.
A gázok oldhatósága a folyadékban nagy mértékben függ a nyomástól is. William Henry
1803-ban felállított törvénye szerint:
x = A . p
ahol x a gáz oldhatósága,
p a gáz parciális
nyomása, A állandó az abszorpciós együttható (abszorpciókoefficiens).
 A gázok vagy gőzök
abszorpciója tehát arányos a gáz
vagy gőz parciális
nyomásával a folyadék fölött. Dalton
mutatott rá, hogy több gáz elegyéből
mindegyik komponens úgy oldódik a folyadékban,
mintha egyedül volna jelen.
A gázok vagy gőzök
abszorpciója tehát arányos a gáz
vagy gőz parciális
nyomásával a folyadék fölött. Dalton
mutatott rá, hogy több gáz elegyéből
mindegyik komponens úgy oldódik a folyadékban,
mintha egyedül volna jelen.
Az A abszorpciókoefficienst különböző módon lehet definiálni. A Bunsen-féle
abszorpciókoefficiens a folyadék
térfogategysége (1 ml) által 1 atm
nyomáson abszorbeált normál milliliterek
száma. Vannak különböző célra használt, más abszorpciókoefficiensek is.
A gyakorlatban a Henry-Dalton-törvény
és Dalton-törvénye jól megközelíti
a valóságot, hacsak nem megy végbe kémiai
reakció a gáz és az oldószer
között.
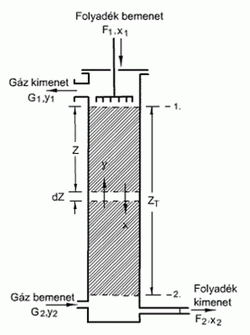
Az iparban elterjedten hasznosított folyamat pl. gázelegyek
szétválasztására, szennyező gázok eltávolítására
(abszorpciós torony - az ábrán).
Ezt az elvet alkalmazzák az abszorpciós
hűtőgépekben is.
Felhasznált irodalom
 A gázok vagy gőzök
abszorpciója tehát arányos a gáz
vagy gőz parciális
nyomásával a folyadék fölött. Dalton
mutatott rá, hogy több gáz elegyéből
mindegyik komponens úgy oldódik a folyadékban,
mintha egyedül volna jelen.
A gázok vagy gőzök
abszorpciója tehát arányos a gáz
vagy gőz parciális
nyomásával a folyadék fölött. Dalton
mutatott rá, hogy több gáz elegyéből
mindegyik komponens úgy oldódik a folyadékban,
mintha egyedül volna jelen.