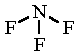 NF3
NF3A nitrogén fluorral alkotott vegyülete.
nitrogén-trifluorid
(nitrogén-fluorid, perfluor-ammónia, trifluor-ammónia, trifluoramin)
 NF3
NF3
A nitrogén fluorral
alkotott vegyülete.
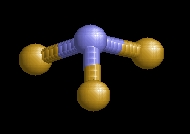
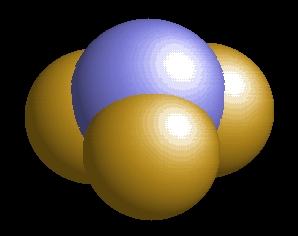
A nitrogén-trifluorid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|
|
Az nf3.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Fizikai tulajdonságai
Szintelen, jellegzetes szagú, gáz.
Olvadáspontja -208,5°C
Forráspontja -129°C
A levegőnél nehezebb.
Vízben nagyon kis mértékben oldódik.
Nem éghető, de fokozza más anyagok égését. Tűzben irritáló vagy mérgező anyagok
keletkeznek belőle.
Erős oxidáló szer.
Reakcióba lép éghető
és redukáló anyagokkal.
Hevesen reagál ammóniával,
szén-monoxiddal, diboránnal, hidrogénnel,
hidrogén-szulfiddal, metánnal vagy
tetrafluorhidrazinnal,
robbanásveszélyt okozva.
Megtámadja a fémeket.
Elektromos szikra hatására elbomlik.
Rendkívül erősen üvegházhatású gáz,
de a légkörbe csak nagyon kis mennyiségben jut, mert felhasználása során elbomlik.
(Becslések szerint a 2007-ben gyártott 4000 tonna gáz 2%-a került a légkörbe.)
Előállítás
Leggyakrabban ammónia és fluor reakciójával állítják elő.
Felhasználás
A mikroelektronikában használják fluorozószerként, integrált áramkörök szilícium
felületének plazma-maratásánál. Használata során nitrogénre és fluorra bomlik
és a keletkező fluor aktív tisztítószerként viselkedik a szilícium felületen. Erre
a célra környezetvédelmi okokból kezdték el alkalmazni a halogénezett szénhidrogének
helyett.
A hidrogén-fluorid és deutérium-fluorid vegyi lézerekben is használják.
Alkalmazzák az LCD képernyők gyártásánál is.
Biológia
Nagy koncentrációja
a levegőben oxigénhiányt
okozhat az eszméletvesztés vagy halál kockázatával.
Hosszabb idő alatt hatással lehet a vesére és a májra.
Ismételt vagy tartós belégzése fluorózist okozhat.