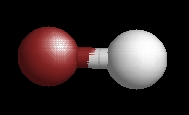
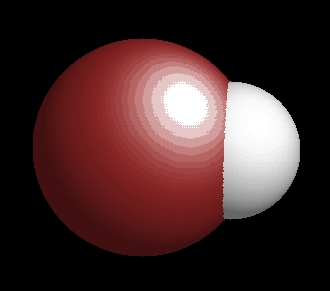
hidrogén-bromid
(bróm-hidrogén)
HBr Régen bróm-hidrogénnek is nevezték. A hidrogén brómmal alkotott vegyülete.
A hidrogén-bromid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.

|

|
A HBr.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Előállítás
Sósavhoz hasonlóan előállítható hidrogénből és brómgőzből, ez azonban gyakorlati
szempontból nem előnyös.
Általában nátrium-bromid híg kénsavval
2 NaBr + H2SO4 = 2 HBr + Na2SO4
(A tömény kénsav brómmá oxidálná.)
Kén-hidrogénből is előállítható brómmal
H2S + Br2 = 2 HBr + S
Fizikai és kémiai tulajdonságok
Szobahőmérsékleten színtelen, szúrós szagú, levegőn füstölgő, mérgező gáz.
Forráspont: -66,7°C
Olvadáspont: -86,9°C
Sűrűség: 3,307 g/l
(20 °C), gáz
Oldhatósága vízben,
20°C-on: 193 g/100 ml
Mindenben hasonlít a sósavhoz, de bomlékonyabb.
Telített vizes oldata
15°C-on 65,6%-os, igen erős sav.
A HBr gáz magas hőmérsékleten erősebben disszociál, mint a HCl.
Oxigénnel fény hatására vízzé és brómmá
oxidálódik, ezért oldata levegőn könnyen megbarnul.
Aktívabb fémeket, oxidokat, hidroxidokat, karbonátokat, stb. bromidokká alakít
át.
Sói a bromidok, általában hasonlóak a megfelelő kloridokhoz a vegyület karaktere
és szerkezete szempontjából.
Felhasználás
Vegyipari, laboratóriumi, analitikai,
valamint orvosi és gyógyászati célra.