 H2O2
H2O2 hidrogén-peroxid
(hidrogén-szuperoxid)
 H2O2
H2O2
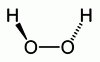
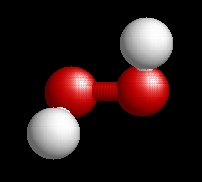
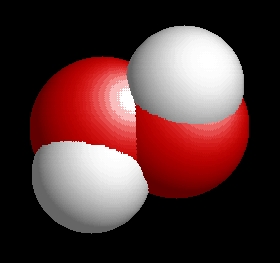
A hidrogén-peroxid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|
|
A h2o2.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Előállítás
Laboratóriumban bárium-peroxid és híg kénsav reakciójával:
BaO2 + H2SO4 = BaSO4 + H2O2
Iparilag kénsav elektrolízisével:
H2SO2 -> H+ + HSO2-
Ekkor a katódon redukálódó hidrogén-szulfát ionok peroxi-dikénsavvá egyesülnek:
2 HSO4 -> H2S2O8
A peroxi-dikénsav vizes oldata 80-100 °C-on kénsavra és hidrogén-peroxidra hidrolizál:
H2S2O8 + 2 H2O -> 2 H2SO4 + H2O2
Fizikai és kémiai tulajdonságai
Halványkék színű folyadék,
híg oldatban színtelen.
Olvadáspont: -0,43°C
Forráspont: 150,2°C
Sűrűség: 1,46 g/cm3
Vízben jól oldódik.
Gyenge sav.
Molekulája a vízhez hasonlóan erősen poláros.
A molekulák közötti hidrogénkötések
miatt aránylag magas az olvadáspontja és forráspontja.
A molekula két oxigénatomja
közvetlenül, gyenge peroxikötéssel kapcsolódik ezért könnyen leadja az oxigént,
erős oxidálószer.
Bomlékony anyag, bomlásakor víz és oxigén keletkezik:
2 H2O2 = 2 H2O + O2
Vizes oldata is bomlékony, 30%-osnál töményebb oldata már robbanásveszélyes.
Hő, napfény és szerves anyagok hatására különösen bomlékony. Éghető szerves anyagon megszáradva tüzet okozhat.
 Felhasználás
Felhasználás
Oxidálószerként (rakétahajtóanyagokhoz is)
Fertőtlenítőszerként
Szőkítésre
Fehérítésre
Biológia
Gőze irritálja a nyálkahéártyákat.
Bőrre kerülve kifehéríti, roncsolja.