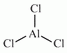
 AlCl3, az alumínium klórral
alkotott vegyülete.
AlCl3, az alumínium klórral
alkotott vegyülete.
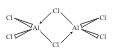
Könnyen dimerizálódik Al2Cl3 molekulákká.
alumínium-klorid
(alumínium-triklorid)

 AlCl3, az alumínium klórral
alkotott vegyülete.
AlCl3, az alumínium klórral
alkotott vegyülete.
Könnyen dimerizálódik Al2Cl3 molekulákká.
 Fizikai és kémiai tulajdonságok
Fizikai és kémiai tulajdonságok
Fehéres, szilárd anyag.
A vízmentes só hexagonális kristályokat képez.
A hexahidrát forma (AlCl3.6H2O) rombos kristályrácsú.
Sűrűsége 2,44 g/cm3 (olvasztott állapotban), 2,398 g/cm3
(hexahidrát)
Olvadáspontja 190°C
Melegítve 100°C-on elveszti kristályvizét, tovább melegítve 178°C-on szublimál.
Mindkét forma cseppfolyósítható.
A levegő nedvességével füstöt képez.
Hevesen reagál vízzel (hidrogén-klorid képződése
közben hidrolizál):
AlCl3 + 3 H2O <-> Al(OH)3 + 3 HCl
Mivel az alumínium kis, pozitív
ionjának polarizálja
a kloridiont, a
szilárd anyagban
a kötés átmenet
a kovalens és ionos
között.
Folyékony és gázhalmazállapotban dimer molekulaként, Al2Cl6-ként
van jelen, amelyben klorid-hidak hozzák létre a koordinatív kötést az alumíniumatommal.
Az AlCl3-molekula képes más, elektronpár átadására képes vegyületekkel, például
aminokkal, vagy hidrogén-szulfiddal is reagálni, azaz Lewis-savként viselkedik.
Magas hőmérsékleten az Al2Cl6-molekulák a gőzben planáris
AlCl3-molekulákra disszociálnak.
Előállítás
Hidrogén-kloridot vagy klórt vezetve forró alumínium felett:
2 Al + 3 Cl2 -> 2 AlCl3
Iparilag, klórt átvezetve hevített alumínium-oxidon és szénen, vagy
timföldből klórgáz és szén-monoxid elegyével (a keletkező foszgénnel):
3 CO + 3 Cl2 -> 3 COCl2
Al2O3 + 3 COCl2 -> 2 AlCl3 + 3 CO2
Felhasználás
Az iparban olajok krakkolásánál használják katalizátorként.
Néhány más szerves kémiai
reakciónak is katalizátora,
különösen a Friedel-Crafts reakcióké.
Izzadás elleni szerek alapanyaga.