A folyadékban történő áramlás és vegybontás magyarázata
1. Tudjuk, hogy a fémekben az elektromos áram nem más, mint a szabad elektronok
mozgása.
A folyadékokban nem így történik az áramlás. Lássuk a rézgálicoldat esetét,
a rézgálic-molekula összetétele CuSO4. Ez annyit jelent, hogy a rézgálic-molekulában
van egy réz- (kuprum-) atom, egy kén- (szulfur-) atom ás négy oxigén-atom. Ez a molekula semleges, természetes állapotban van, kifelé nem mutat elektromos töltést.
|
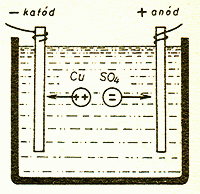
Az ionok az ellenkező töltésű elektródok felé vándorolnak
|
|
De más lesz a helyzet, ha a rézgálicot
a vízben feloldjuk. Ekkor a rézgálic-molekulák
egy része kétfelé bomlik. Az egyik rész a Cu (réz),
a másik az SO4. Az érdekes és fontos körülmény az, hogy a réz
pozitív, az SO4 pedig negatív töltésű. Ionok keletkeznek.
Ha tehát sót vagy savat (pl. kénsavat, H2SO4) oldunk a vízben, az oldott anyag molekuláinak egy része két részre válik (disszociálódik).
Az egyik rész pozitív töltésű, ez a pozitív ion (pl. Cu2+) a másik rész
negatív töltésű, ez a negatív ion (pl. SO42-).
Mindig a fémek
és a hidrogén ionjai pozitívak. Ha tehát az elektródokat áramforrással
kötjük össze, a pozitív ionok (H és a fémek)
a negatív lemez, a katód felé vándorolnak. Az ionok a folyadékban
igen lassan mozognak, percenként 1 mm utat sem tesznek meg. A folyadékokban
tehát a negatív ionok hordozzák az elektronokat,
amelyek a fémekben
szabadon mozognak.
|
A pozitív ionokon (pl. a rézionon) elektronhiány van. Amikor a negatív elektródhoz
érnek, felvesznek annyi elektront, amennyi a természetes állapothoz szükséges,
és vagy rárakódnak az elektródra (mint a réz), vagy pedig gázállapotban felszállnak
(mint a hidrogén).
A negatív töltésű
ion a pozitív
elektródhoz vándorol, ott leadja fölös számú elektronjait,
és kiválik. Igen gyakori a másodlagos folyamat, amikor ez a negatív
ion - rendszerint savmaradék
- az anóddal vagy az
oldószerrel vegyületet
képez. Például a víz elektrolízisekor
az SO4 savmaradék a vízmolekula
hidrogénjével kénsavat
alkot, és oxigén szabadul
fel.
2. Az áramerősség mérése. A kísérletek szerint
1 amper áram 1 másodperc alatt 0,33 milligramm rezet vagy 1,118 milligramm
ezüstöt választ ki.
Ennek alapján egy ismeretlen áramerősség mérhető.
Például az ábrán látható kísérletünkben az áram rézgálicoldaton haladt keresztül,
és a negatív sarokkal összekötött szénrúdra réz rakódott le. Az áramot 10
percig vezettük az oldaton keresztül. A szénrúd súlya a rárakódott réztől
19,8 milligrammal lett nagyobb. Ezt mérleggel állapítjuk meg. Mekkora az áram erőssége?
10 perc = 600 másodperc alatt kivált 19,8 milligramm réz.
1 másodperc alatt 19,8 : 600=0,033 mg réz vált ki.
Mivel 1 amper áram.
1 másodperc alatt
0,33 milligramm rezet választ
ki, kísérletünkben másodpercenként
ennél 10-szer kevesebb réz
rakódott le a szénrúdra,
ezért az áram erőssége
0,1 amper.
Felhasznált irodalom
