 A forráspont-emelkedés
kolligatív tulajdonság.
A forráspont-emelkedés
kolligatív tulajdonság.Híg oldatok esetén az oldott anyag részecskéi (molekulák, ionok) gyakorlatilag nincsenek kölcsönhatásban. Ezért a híg oldatokban az oldószer viselkedése mindig ideális. E miatt tulajdonságai (intenzív változói) a tiszta állapotbeli értékből a móltörttel egyenesen arányosan számíthatók.
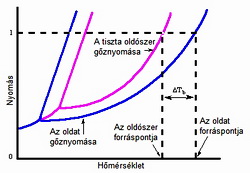
Tiszta folyadékok forráspontja az anyagra jellemző érték.
Ideális elegyekben az elegy egyensúlyi gőztenziója a komponensek moltörtjeinek és a tiszta komponensek egyensúlyi gőztenzióinak szorzatösszege.
Amennyiben az egyik komponens gőztenziója nulla, akkor az adott komponens moltörtje arányában csökken az oldat egyensúlyi gőztenziója. A gőztenzió csökkenése vezet a forráspont-emelkedéshez. Az oldat forráspontja a gőztenzió csökkenése miatt nagyobb, mint a tiszta oldószeré.
A két hőmérséklet közötti különbség a forráspont-emelkedés (DTb).
Értékét a következő egyenlet adja: