oktett
(oktett szabály)
Nyolcas csoport, a kémiában egyes elemeknél, amelyek legstabilabb vegyületeiben
nyolc vegyértékelektron található minden atom körül, akár ionképződéssel, akár
kovalens kötésben elektronmegosztással.
A vegyértékelektronok oktettjét
nemesgázkonfigurációnak
is nevezik.
Az oktett szabály azt jelenti, hogy az elemek, amikor lehetséges, nyolc
külső elektronra (4 elektron pár) "törekszenek" a külső héjon.
Mivel a nyolc külső elektron viszonylag stabil, sok elem elektron leadással,
vagy felvétellel éri el a legközelebbi nemesgázhoz hasonló külső elektronhéjat.
 A nátrium
elektronkonfigurációja 1s22s22p63s1.
A nátrium
elektronkonfigurációja 1s22s22p63s1.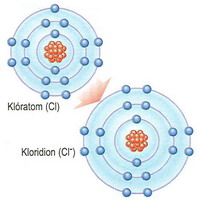 A Klór elektronkonfigurációja
1s22s22p63s23p5.
A Klór elektronkonfigurációja
1s22s22p63s23p5. Az oktett szabály azonban nem jósolja meg minden molekula és vegyület esetén az
elektronkonfigurációt sem a nem fémek sem a fémek esetén. Bizonyos atomok esetén
négynél több elektronpár alakul ki.
A szabály általában az Ia oszlop és IIa oszlop fémeire és a nem fémekre igaz,
de pl. az átmeneti elemek esetén nem.