kovalens kötés
(homoöpoláris kötés, datív kötés, dipoláris kötés, koordinatívkötés, szemipoláris kötés, donor, akceptor, szigma-kötés, szigma-elektron, delta-kötés, pi-kötés, pi-elektron, kötő pálya, bonding orbital, lazító pálya,anti bonding orbital)
Ezt a kémiai kötéstípust azért nevezik,
homoöpoláris kötésnek, mert a benne résztvevő atomok
hasonló polaritásuak.
 Ebben a kötéstípusban az atomokat egy vagy több olyan
elektronpár tartja össze, amely a kötésbe lépett
atomok egy-egy elektronjából
tevődik össze. Az így létrejött elektronpár
közösen tartozik a két atomhoz
és együttesen egészítik ki a kötésben
lévő atomok e nélkül
tökéletlen nemesgáz-konfigurációját.
Előfordul, hogy a két atom
között két vagy három elektronpár kialakítására
is szükség van ahhoz, hogy az elektronoktett (nemesgáz-konfiguráció)
létrejöjjön.
Ebben a kötéstípusban az atomokat egy vagy több olyan
elektronpár tartja össze, amely a kötésbe lépett
atomok egy-egy elektronjából
tevődik össze. Az így létrejött elektronpár
közösen tartozik a két atomhoz
és együttesen egészítik ki a kötésben
lévő atomok e nélkül
tökéletlen nemesgáz-konfigurációját.
Előfordul, hogy a két atom
között két vagy három elektronpár kialakítására
is szükség van ahhoz, hogy az elektronoktett (nemesgáz-konfiguráció)
létrejöjjön.
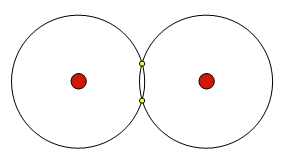
Egy hidrogén molekulában
a két atom s-pályái
átlapolódnak és a két atom között molekulapályát
hoznak létre.Ilyen kovalens kötés tartja össze például a H2
(az ábrán), Cl2,
O2, CH4,
C2H6,
stb. molekulákat. A legtöbb szerves vegyület
molekuláira ez jellemző. Ezek az anyagok
nem ionokból állnak, tiszta állapotban sem
magas sem alacsony hőmérsékleten nem
vezetik az áramot. Számos gáz halmazállapotú
vagy könnyen illó anyag van köztük. Nemvizes oldószerekben jól oldódnak. Mások
közülük igen stabil atomrácsot alkotnak
(óriásmolekulák), mint például a gyémánt
(C), szilicium-karbid (SiC), stb.
A szerves kémiában a közös vegyértékpárt
általában egy egyszerű vegyértékvonallal
ábrázolják. Vannak kettős vagy hármas kötések
is, amelyeket kettő illetve három párhuzamos vonallal jelölnek. Pl. szén-dioxid
(O=C=O), etilén (H2C=CH2),
acetilén (HC=CH). Ezekben az
esetekben a vonallal összekötött atomokban
két vagy három elektronpár közös.
A kettős, illetve hármas kötés nem jelent kétszer vagy háromszor olyan erős
kapcsolatot. Pl. az alifás C-C kötés
bontásához 71 kcal-mol, a C=C kettős kötés bontásához csak 125 kcal-mol energiára
van szükség (vagyis nem 2x71=142 kcal-mol energiára).
datív kötés (dipoláris, koordinatív vagy szemipoláris kötés)
A kovalens kötés speciális esete. (Neve a latin dare adni igéből ered.)
Itt az egyik atom adja a kötéshez szükséges
elektronpár mindkét elektronját.
A kötés tehát úgy is értelmezhető, mintha az egyik atom,
(az úgynevezett donor) átadott volna a másiknak egy elektront
és ez, valamint a donor egy továnni elektronja
létesítené a kötő-elektronpárt.
D:(donor) + A (akceptor) -> D:A
A datív kötésben - a kovalens kötéssel ellentétben - az elektronátadás
és -átvétel miatt töltéseltolódás következik
be. A donor pozitív az akceptor, pedig negatív eltolódást szenved.
A datív kötés jellemző esete a szén-monoxid
molekula létrejötte. A szén-monoxid
molekula képződését sem ionos-, sem
kovalens kötéssel nem lehet úgy magyarázni, hogy elektronokból
oktett jöjjön létre. Így feltételezzük,
hogy a két atom között két-két elektron
felhasználásával kialakul két kovalens kötés (kettős-kötés);
ezen kívül létrejön még egy datív kötés az oxigén
szabad elektronpárjának segítségével.
Annak feltüntetésére, hogy a datív kötésben elektronátadás
történik, a következő jelölést alkalmazzák:
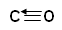
A kovalens kötésnek különböző típusai vannak:
 A tengelyszimmetrikus
molekulapályán, két atommagon átmenő,
egyenes szimmetriatengelyű kovalens kötést szigma-kötésnek nevezik
(jele: s).
A tengelyszimmetrikus
molekulapályán, két atommagon átmenő,
egyenes szimmetriatengelyű kovalens kötést szigma-kötésnek nevezik
(jele: s).
Ez a legerősebb kovalens kötés.
A kötésben részt vevő elektronokat
szigma-elektronoknak is nevezik.
A szigma-kötések mentén lehetséges az atomok
rotációja (forgása).
Ilyen kötés található például az etánmolekulában.
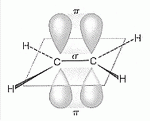 Kettős kötés
esetében az egyik kötés a tengely vonala körüli átlapolódással hoz létre egy
szigma kötést. A másik a párhuzamos tengelyű p-pályák
oldalirányú átlapolódásával keletkezik. A keletkező pályának két része van,
a szigma kötés sikja alatt és felett létrejövő kovalens kötést
pi-kötésnek nevezik (jele: p).
Kettős kötés
esetében az egyik kötés a tengely vonala körüli átlapolódással hoz létre egy
szigma kötést. A másik a párhuzamos tengelyű p-pályák
oldalirányú átlapolódásával keletkezik. A keletkező pályának két része van,
a szigma kötés sikja alatt és felett létrejövő kovalens kötést
pi-kötésnek nevezik (jele: p).
A kötésben részt vevő elektronokat
pi(p)-elektronoknak is nevezik
A Pi-kötés síkszimmetrikus és a szigma-kötés tengelyének szimmetriasíkján
fekszik.
Csak akkor alakul ki, ha a két atom már
egy szigma-kötéssel kapcsolódik, vagyis a kettős
kötés egyike szigma-kötés, a másik pí-kötés, hármas
kötés esetén ehhez még egy pi-kötés járul.
A pi-kötés gátolja a részt vevő atomok
szabad rotációját (forgását).
Ilyen kötés található például az etilénmolekulában.
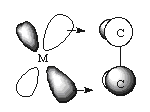 A két
oldalirányú delta (d) pálya
átfedésével létrejövő kovalens kötést delta-kötésnek nevezik (jele:
d).
A két
oldalirányú delta (d) pálya
átfedésével létrejövő kovalens kötést delta-kötésnek nevezik (jele:
d).
A d-pályát azért nevezik így, mert a molekula
tengelye mentén nézve, alakja emlékeztet a d-pályára,
és két pályaimpulzusmomentum egységgel
rendelkezik a magok közti tengely körül.
Valójában két atompálya kombinációja két, különböző energiájú molekulapályát
hoz létre. Az egyik, az alacsonyabb energiájú a kötő pálya (bonding
orbital), amely összetartja az atomokat, a másik, a lazító pálya
(anti bonding orbital), ami el akarja távolítani az atomokat egymástól.
A vegyértékelektronok esetében csak az alacsonyabb energiájú, kötő pálya van
feltöltve.
A d-kötés különböző atomok
d-pályáinak átlapolásából jön létre.
A delta-kötések hozzájárulnak az átmeneti
fémek klaszter vegyületeinek kötéséhez.
Ilyen kötés található például az acetilénmolekulában.
Felhasznált irodalom
 Ebben a kötéstípusban az atomokat egy vagy több olyan
elektronpár tartja össze, amely a kötésbe lépett
atomok egy-egy elektronjából
tevődik össze. Az így létrejött elektronpár
közösen tartozik a két atomhoz
és együttesen egészítik ki a kötésben
lévő atomok e nélkül
tökéletlen nemesgáz-konfigurációját.
Előfordul, hogy a két atom
között két vagy három elektronpár kialakítására
is szükség van ahhoz, hogy az elektronoktett (nemesgáz-konfiguráció)
létrejöjjön.
Ebben a kötéstípusban az atomokat egy vagy több olyan
elektronpár tartja össze, amely a kötésbe lépett
atomok egy-egy elektronjából
tevődik össze. Az így létrejött elektronpár
közösen tartozik a két atomhoz
és együttesen egészítik ki a kötésben
lévő atomok e nélkül
tökéletlen nemesgáz-konfigurációját.
Előfordul, hogy a két atom
között két vagy három elektronpár kialakítására
is szükség van ahhoz, hogy az elektronoktett (nemesgáz-konfiguráció)
létrejöjjön. 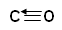
 A tengelyszimmetrikus
A tengelyszimmetrikus

 A két
oldalirányú delta (d)
A két
oldalirányú delta (d)