 Oldatok
savasságának (aciditás) és lúgosságának (alkalikusság)
mértékét kifejező logaritmikus skála.
Oldatok
savasságának (aciditás) és lúgosságának (alkalikusság)
mértékét kifejező logaritmikus skála. Közelítőleg az oldat hidrogénion koncentrációjának negatív logaritmusával egyenlő.
kémhatás
(pH, pH-skála, savasság, aciditás, lúgosság, alkalikusság, semleges, savas, lúgos kémhatás, bázisos, bázikus, oxóniumion, hidróniumion, hidroxóniumion)
 Oldatok
savasságának (aciditás) és lúgosságának (alkalikusság)
mértékét kifejező logaritmikus skála.
Oldatok
savasságának (aciditás) és lúgosságának (alkalikusság)
mértékét kifejező logaritmikus skála.
Közelítőleg az oldat hidrogénion koncentrációjának
negatív logaritmusával egyenlő.
A képen egy univerzális indikátorpapír-tekercs oldalán a különböző pH értékekhez tartozó elszíneződésekkel.
Kicsit szemléletesebben az Érdekességeknél Környezetünk "savanyúsága" - Savak és lúgok címen foglalkozom a témával.
A víz esetében a hidrogén
(oxónium)- és hidroxidionok
koncentrációjának szorzata kb. 10-14
(szobahőmérsékleten), ebből következően
bármely vizes oldat pH-értéke 1 és 14
között kell hogy legyen.
A semleges kémhatású oldatok pH-értéke
7, 7 alatt az oldat savas, 7 felett lúgos
kémhatású.
A víz autoprotolíziséből H2O+ H2O <->
H3O+ + OH- következően a tiszta víz
is tartalmaz oxónium- és hidroxidionokat.
Például 25°C-on:
[H3O+] = [OH-] = 1x10-7 mol/dm3
Ezek koncentrációját a bevitt savak
és bázisok megváltoztatják.
A bevitt sav növeli az oxóniumion-koncentrációt,
ezzel - a kémiai egyensúly törvénye miatt - csökkenti a víz
autoprotolíziséből származó hidroxidion-koncentrációt.
A bevitt bázis növeli a hidroxidion-koncentrációt,
lúgos kémhatást okoz. Csökkenti a víz
autoprotolízisét, és ezzel visszaszorítja az oxóniumionok koncentrációját.
A 25°C-on fennálló összefüggés:
Kv= [H3O+].[OH-]= 1x10-14
Semleges kémhatású oldatban az ionszorzat: [H3O+]=[OH-]=1x10-7 mol/dm3,
Savas kémhatású oldatban: [H3O+] > [OH-], így [H3O+] > 1x10-7 mol/dm3,
Lúgos kémhatású oldatban: [H3O+]
< [OH-], így [H3O+] < 1x10-7
mol/dm3.
A lúgos kémhatású anyagokat bázisosnak, vagy bázikusnak
is nevezik.
A kémhatás egyszerűbb kifejezésére vezették be a pH fogalmát, amely az oldat hidrogén- (oxónium)ion-koncentrációjának negatív, tízes alapú logaritmusa:
| pH= -lg[H3O]+ |
pKv= pH+ pOH= 14 (25°C-on!)
Az oxóniumiont nevezik még hidróniumionnak vagy hidroxóniumionnak is. A különböző kémhatású oldatok pH-ja:
Pontosabban, a pH nem a hidrogénion koncentrációjájától, hanem az aktivitásától függ, amely azonban kísérletileg nem mérhető.
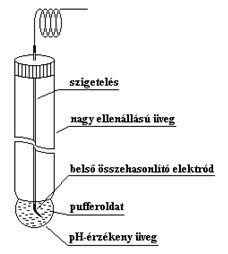 Gyakorlati célokra a pH-t, a vizsgálandó oldatban hidrogén elektróddal, mint félcellával határozzák meg, egy referencia elektródot (pl. kalomel elektród) használva másik félcellaként.
Gyakorlati célokra a pH-t, a vizsgálandó oldatban hidrogén elektróddal, mint félcellával határozzák meg, egy referencia elektródot (pl. kalomel elektród) használva másik félcellaként.
A pH ekkor (E-ER) F/2,303RT,
ahol
E - a cella elektromotoros ereje
ER- a referencia elektród standard potenciálja
F - a Faraday-állandó.
A gyakorlatban az üvegelektród (az ábrán) használata sokkal kényelmesebb, mint a hidrogén elektródé.