elektronegativitás
(Mullikan-elektronegativása, Pauling-féle elektronegativitás)
Kötött atomok elektronvonzó
képességének mértéke.
Poláros molekulák esetén a nagyobb elektronegativitású
atom alkotja a dipólus
negatív pólusát (pl. a víz esetén az oxigén).
Nagyjából arányos az ionizációs energia
és az elektronaffinitás összegével.
Az elektronegativitást különböző módokon lehet egy elemhez
hozzárendelni.
Mullikan-elektronegativása az
E = (I + A) / 2
képlettel számolható,
ahol
E az elektronegativitás,
I az ionizációs potenciál és
A az elektronaffinitás.
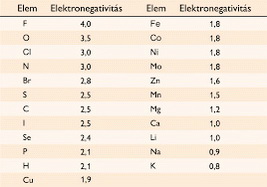 Általánosabban használják a Pauling-féle elektronegativitást,
ami a kötések disszociációs
energiáján alapul, és egy skálát használ, ahol a fluornak,
a legelektronegatívabb elemnek
az elektronegativitása 4.
Általánosabban használják a Pauling-féle elektronegativitást,
ami a kötések disszociációs
energiáján alapul, és egy skálát használ, ahol a fluornak,
a legelektronegatívabb elemnek
az elektronegativitása 4.
Néhány más érték ezen a skálán: bór 2; szén
2,5; nitrogén 3,0; oxigén
3,5; szilícium 1,8; foszfor
2,1; kén 2,5; klór 3,0; bróm 2,8.
más nemfémek esetén értéke: 2 - 2,2 közötti
fémek esetén értéke: 0,7 - 1,8 közötti
Felhasznált irodalom
 Általánosabban használják a Pauling-féle elektronegativitást,
ami a kötések disszociációs
energiáján alapul, és egy skálát használ, ahol a fluornak,
a legelektronegatívabb elemnek
az elektronegativitása 4.
Általánosabban használják a Pauling-féle elektronegativitást,
ami a kötések disszociációs
energiáján alapul, és egy skálát használ, ahol a fluornak,
a legelektronegatívabb elemnek
az elektronegativitása 4.