 Egyesüléses
reakciók pl.
Egyesüléses
reakciók pl. - a hidrogéngáz és az oxigéngáz egysülése vízgőzzé
2H2 + O2 -> 2H2O
- a hidrogéngáz és az klórgáz egysülése sósavvá
H2 + Cl2 -> 2HCl
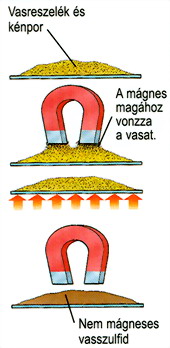
- a vaspor és kénpor keverékének egyesülése vas-szulfiddá (ábra)
Fe + S -> FeS
egyesülés
(szintézis, kémiai egyesülés, a kémiai egyesülés törvényei, egyenlő arányok törvénye, állandó arányok törvénye, reciprok arányok)
A kémiai reakciónak az a fajtája,
amikor két anyag egyetlen újabb anyaggá egyesül.
Elemek egyesülése vegyületek képződése közben.
A kémiai egyesülésnek három törvénye van:
1. Az állandó tömegarányok törvénye
kimondja, hogy az elemek aránya egy vegyületben mindig azonos, függetlenül a
vegyület előállításának módjától.
Például a vízben az oxigén
és a hidrogén tömegaránya
8:1.
(2.) A többszörös tömegarányok törvénye
kimondja, hogy amikor két elem, A és
B egyesül, és egynél több vegyület
képződik, akkor B tömegei, amelyek A adott
tömegével egyesülnek egyszerű többszörösei
egymásnak.
Például a szén kétféle
oxidot képez. Egyikben 12 g szén
egyesül 16 g oxigénnel (CO); a másikban 12 g szén
egyesül 32 g oxigénnel (CO2).
A rögzített mennyiségű szénnel
egyesülő oxigének aránya 16:32, azaz az oxigén tömegeinek az aránya 1:2.
(3.) Az egyenlő arányok törvénye kimondja, hogy ha két elem
A és B mindegyike vegyületet képez
egy harmadik elemmel, C-vel, akkor A
és B vegyülete olyan relatív arányban
fogja tartalmazni A-t és B-t, amilyen arányban C-vel reagálnak. Például mind
a kén, mindpedig a szén
képez vegyületet a hidrogénnel.
A metánban 12 g szén reagál
4 g hidrogénnel. A
hidrogén-szulfidban 32 g kén
reagál 2 g hidrogénnel.
(azaz 64 g kén 4 g hidrogénnel).
A kén és a szén
vegyületet képez, amelyben a C:S arány
12:64 (azaz CS2). A törvényt néha reciprok arányoknak is nevezik.
 Egyesüléses
reakciók pl.
Egyesüléses
reakciók pl.
- a hidrogéngáz és
az oxigéngáz egysülése
vízgőzzé
2H2 + O2 -> 2H2O
- a hidrogéngáz és
az klórgáz egysülése
sósavvá
H2 + Cl2 -> 2HCl
- a vaspor és kénpor
keverékének egyesülése vas-szulfiddá
(ábra)
Fe + S -> FeS