 Meghatározott
frekvenciákat tartalmazó elektromágneses
sugárzás, jellegzetesen fény, amely
a sugárzást kibocsátó, illetve elnyelő atomra
jellemző.
Meghatározott
frekvenciákat tartalmazó elektromágneses
sugárzás, jellegzetesen fény, amely
a sugárzást kibocsátó, illetve elnyelő atomra
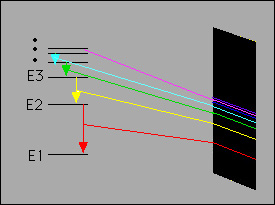
jellemző. Egy adott színképvonal (frekvencia) megfelel az elektron két meghatározott energiaszint közötti átmenetének (lásd az ábrán).
Emissziós színkép akkor keletkezik, ha az atomokkal energiát közölnek - pl. hőközléssel vagy elektromos gerjesztéssel -, így az elektronok magasabb energiaszintre ugranak, a gerjesztett elektronok fényt bocsátanak ki, miközben visszatérnek a gerjesztetlen állapotba. Az abszorpciós színképeket olyankor figyelhetjük meg, amikor egy anyagon fényt bocsátunk keresztül.
Az infravörös színkép a molekuláris rezgéseknek és forgásoknak felel meg; a röntgenszínkép pedig a nehéz atomok belső elektronátmeneteinek.
A színképek vizsgálata a színképelemzés vagy spektroszkópia: ez a kémiában és a fizikában fontos analitikai módszer.
Johann Balmer svájci fizikus és mások a hidrogénszínkép törvényszerűségeinek felismerésével hozzájárultak a kvantummechanika kialakulásához.
A sokelektronos atomok esetén az atomszínképének értelmezésére a Hund-szabályok alkalmazhatók.