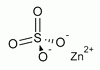 ZnSO4
ZnSO4A cink kénsavval alkotott sója.
Régen cinkvitriol, cinkgálic, fehérgálic néven is említették.
cink-szulfát
(cinkvitriol, cinkgálic, fehérgálic, Goslarit)
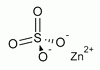 ZnSO4
ZnSO4
A cink kénsavval
alkotott sója.
Régen cinkvitriol, cinkgálic, fehérgálic néven is említették.
 Előfordulás
Előfordulás
A természetben kristályos
formában is előfordul a Goslarit nevű ásványban
(a képen) és egyes bányavizekben oldat
formájában.
Előállítás
A cink-szulfidot levegőn hevítve:
ZnS + 2 O2 -> ZnSO4
A keletkező cink-szulfátot kioldják és kikristályosítják. (Ezzel az
eljárással csak szennyezett állapotban állítható elő.)
Tiszta állapotban cinkből állítható elő
kénsavval:
Zn + H2SO4 -> ZnSO4
Fizikai és kémiai tulajdonságai
Fehér kristályos
anyag.
Közönséges formája a heptahidrát (ZnSO4.7H2O), ami 30°C-on
hexahidráttá , majd 70°C-on monohidráttá alakul és 280°C-on teljesen elveszti kristályvizét.
Tovább hevítve 500°C felett elbomlik.
Sűrűség: 1,9 g/cm3
(heptahidrát)
Vízben oldódik.
Oldatban hidrolizál, savas kémhatású.
Kénnel vagy szénnel cink-szulfiddá redukálható.
Felhasználás
Cink előállításakor és tisztításakor.
Oldatát galvanizáláskor cinkbevonatokhoz.
Fák impregnálásakor.
Bőrök tartósításához.
A gyógyászatban fertőtlenítő-
és összehúzó- (vérzéscsillapító) szerként, továbbá híg oldatát szemöblítőként.
Textilfestésnél pácként.
Komplex műtrágyákban nyomelemként.
Biológia
Mérgező hatású, a fehérjéket kicsapja.
Hánytató hatású.
Bőrre kerülve fekélyeket okozhat.