víz - egy "különleges" anyag
(jég, jéghegy, édesvíz, desztillált víz, vízkörforgás, vadózus vizek, juvenilis vizek)
 Bár földünk
kétharmadát víz (H2O) borítja, testünknek is körülbelül kétharmada
víz, tehát szinte mindenütt jelen van környezetünkben (a képen például
mindenféle halmazállapotában megtalálható), mégis egy igazán különleges
anyagról van szó.
Bár földünk
kétharmadát víz (H2O) borítja, testünknek is körülbelül kétharmada
víz, tehát szinte mindenütt jelen van környezetünkben (a képen például
mindenféle halmazállapotában megtalálható), mégis egy igazán különleges
anyagról van szó.
Fizikai és kémiai viselkedésében egyaránt vannak "szokatlan" tulajdonságok.
fizikai tulajdonságai, kémiai tulajdonságai,
biokémiája, előfordulása
Fizikai tulajdonságai
Van egy olyan különleges fizikai tulajdonsága, aminek talán az élet is köszönhető.
A legtöbb anyag minél hidegebb annál kisebb a térfogata. A hidrogénkötés
miatt a víz 4°C-on a legsűrübb, ha ennél melegebb, vagy ennél hidegebb
egyaránt nő a térfogata. Ezért nem fagynak be fenékig a tavak, ennek következtében
a befagyott tavakban sem pusztulnak el a halak, és ezért repeszti szét a jég
az edényeket és a sziklákat is.
 Sűrűsége
Sűrűsége
A víz sűrűsége
4°C-on maximális, 20 °C-on 998,2 kg/m3.
Amikor a víz megfagy,
a hidrogénkötések
főszereplésével egy tetraéderes szerkezet alakul ki, amelyben a térkihasználás
elég rossz, így nagy hézagok, üregek vannak benne (lásd a jég kristályszerkezetét
lentebb a molekulaképen). Ez okozza azt, hogy a jég sűrűsége
kisebb, mint a vízé és fagyáskor a többi anyagtól eltérően a víz
térfogata megnő (mintegy 9%-kal). Ezért úszik a jég a vizen -
ahogyan a képen látható jéghegy.
A jég 9 féle módosulatban kristályosodik ki.
 Fajhője
Fajhője
A víz nagyon gyakran használt fűtő - és hűtőközeg, mert igen nagy a fajlagos
hőkapacitása (fajhője).
A víz fajhője 20 °C-on, c = 4187 J× kg-1× K-1.
Hűtőközegként (is) használják a vizet például az erőművekben is.
(A képen a visontai hőerőmű - baloldalt a vízhűtőtornyok.)
A víz a lakások fűtőközege is, hiszen már a rómaiak is használták a padlófűtést,
a radiátorban szintén ez biztosítja a téli hónapokban a meleget.
A víz nagy fajhője
jelentős szerepet játszik az éghajlat
és az időjárás alakulásában.
Párolgáshője
Hasonlóan a fajhőhöz
a víz párolgáshője
is igen nagy. Ennek oka a víz molekulaszerkezetében keresendő. A hidrogénkötések
miatt ugyanis nagyobb energia szükséges a molekulák kilépéséhez a klaszterszerkezetből.
A víz fajlagos párolgáshője 2,25× 106 J/kg.
Az élő szervezetben is fontos szerepet jászik a víz nagy párolgáshője
miatt.
 Halmazállapotváltozásai
Halmazállapotváltozásai
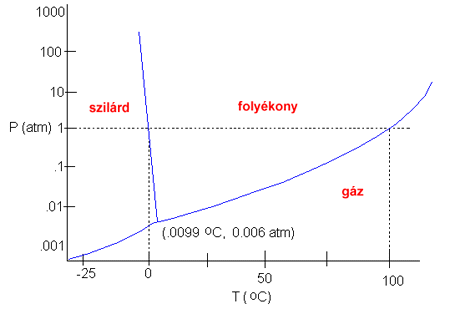
A víz fázisdiagramjáról
(ábra) a lehetséges halmazállapotváltozások
és a hozzájuk tartozó adatok (nyomás /p/, hőméréklet /T/) is leolvashatók. A
halmazállapotváltozások
közben a hőmérséklet
nem változik.
A víz minden hőmérsékleten
párolog valamilyen
mértékben, forráskor
azonban teljes térfogatában párolog.
A forrás az úgynevezett forrásponton
következik be, melynek értéke a nyomástól
is függ (lásd a fázisdiagramon).
A víz forráspontja
közönséges körülmények között 100,15 °C.
A párolgáshoz energiabefektetésre
van szükség, amit a párolgáshő
jellemez.
A forráspont a nyomás
függvénye. Kisebb nyomáson
a víz forráspontja
is alacsonyabb. Így, ha pl. a Himaláján főzünk, akkor a víz 100 °C alatt
forrásba jön, mondjuk
a bableves mégsem fő meg (ahhoz 100 °C kell).
A vízgőz gyakran
lecsapódik hideg
felületeken vagy kisméretű szilárd
részecskéken (pl. köd).
A lecsapódás jelenségén
alapszik a desztilláció
is, amelynek segítségével vizes oldatokat
is szét lehet választani.
A vízben levő hidrogénkötések
miatt a jég hézagos szerkezetű, térfogata kb. 9%-kal nagyobb, mint a
vízé.
A fagyás hőmérséklete
a fagyáspont, mely
szintén függ a nyomástól.
A fagyásponthoz hasonlóan
az olvadáspont is
függ a nyomástól.
A tiszta víz olvadáspontja 0 °C, de ha a víz nem tiszta,
akkor ez az érték más.
Ezen alapszik az utak sózása, mert a só
a jéggel (hóval)
keveredve lecsökkenti annak olvadáspontját
(pl. -10 °C-ra), így a hó,
jég elolvad.
Természetes körülmények között a víz többnyire a légkörben
megtalálható gázhalmazállapotban.
A víz kritikus
hőmérséklete 374,2 °C.
Gőzállapotban a molekulák
magányosak. Folyadék
állapotban azonban néhány vízmolekulából álló csoportok alakulnak ki.
A jelenség magyarázata a vízmolekula polaritásában
keresendő. A poláris
kötésekben levő hidrogén
atomok (amelyek részlegesen pozitív töltésűek)
és egy szomszédos vízmolekula (negatív töltésű)
nemkötő elektronpárja
között vonzóerő alakul ki. Ez a molekulák
közötti kölcsönhatás, a hidrogénkötés.
A hidrogénkötés miatt
két szomszédos molekula 1,76 × 10-10 m távolságra közelíti meg egymást.
 Felületi
feszültség
Felületi
feszültség
Ha egy gombot óvatosan a víz felszínére teszünk, akkor azt tapasztaljuk,
hogy az nem süllyed el (a baloldali képen).
Sokszor előfordul, hogy egy pohárba túl sok vizet teszünk, mégsem folyik
ki.
Az előbbi jelenségek arra utalnak, hogy a víz felszínén levő réteg különleges
tulajdonságokkal rendelkezik. A víz belsejében levő molekulákra
minden irányból hatnak erők,
a felszínen levő molekulákra
a folyadék irányából
nagyobb a vonzás, mint a felette levő levegő
részéről. Ezért a felületi rétegben minden molekula
a folyadék belseje
felé szeretne mozdulni. Ennek a felületi rétegnek a vastagsága kb. 10-9
m és úgy viselkedik, mint egy rugalmas, vékony hártya.
 Egyes vízi élőlények a felületi rétegnek köszönhetően képesek a "vizen
járni".
Egyes vízi élőlények a felületi rétegnek köszönhetően képesek a "vizen
járni".
Ilyen például a képen látható molnárka.
A felületi feszültségre vonatkozó törvényszerűségek vizsgálatában kiemelkedő
munkát végzett az egyik legnagyobb magyar fizikus, Eötvös Loránd.
A mosóvízbe adagolt mosószerek módosítják
a víz felületi
feszültségét, ezért felületaktív
anyagoknak nevezzük ezeket.
Kémiai tulajdonságai
A víz a periódusos rendszer
VI. főcsoportjában található oxigén
és a legkisebb kémiai
elem, a hidrogén vegyülete.
A vízmolekula V-alakú és úgynevezet AX2E2 típusú, amely azt jelenti,
hogy egy központi atomhoz
(oxigén) két ligandum
(hidrogén) és két elektronpár
kapcsolódik.
Az oxigén elektronszerkezetét
(1s2 2s2 2p4) tekintve a vegyértékhéjon
levő 6 elektronból
egy-egy kötést létesít egy-egy hidrogénatommal,
a maradék 4 pedig két, kötésben
részt nem vevő (nemkötő) elektronpárt
alkot. A két nemkötő elektronpár
két molekulapályát jelent. A vízmolekula szerkezetét a metán
(VRML modell) (CH4) tökéletes, tetraéderes (kötésszög kb. 109,5°) szerkezete
alapján lehet megérteni. A víz esetén is négy "objektum" kapcsolódik
a központi atomhoz,
csak ez esetben a négy objektum nem egyforma. A két nemkötő elektronpár
(negatív töltése
miatt) taszítja egymást és térigénye is igen nagy. Emiatt a metán
109,5°-os kötésszöge 104,5°-ra csökken. A kötések
polaritása a vízben két tényezőnek a következménye: az oxigén
és a hidrogén elektronegativitása
közötti különbség, másrészt a vízmolekula V-alakja. Az oxigén
ugyanis jobban vonzza a kötésben levő elektronokat
mint a hidrogén, de ha a molekula
egyenes lenne, a két oldalra irányuló hatás kioltaná egymást. Ez olyan, mintha
két ugyanolyan erős ember húzná egy kötél két végét. Ha a kötél V-alakban meghajlik
és úgy húzzák, akkor a két hatás együtt egy elmozdulást eredményez. Ugyanígy
a két O-H
kötésben levő töltéseltolódás
(poláris kötés) polárissá
teszi a molekulát is.
Az atomok között poláros
kovalens kötések kötéstávolsága
pedig 0,96 x 10-10 m.
A vízmolekula aszimmetrikus, dipólus
jellege miatt van egy pozitív és egy negatív vége. Ennek köszönhetően az ionos
vegyületeket (pl. a konyhasót
- NaCl) rendkívül jól oldja. Ionosan disszociálnak benne bizonyos anyagok.
(Az alábbi molekulaképen az "Oldott kloridion" gombra kattintva ez
jól látható.)
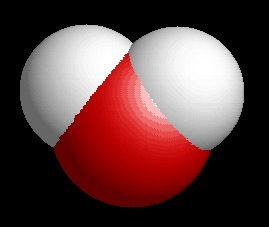
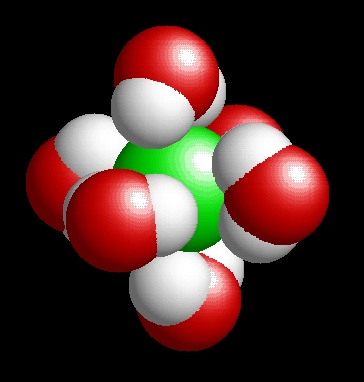
A víz molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben. A
baloldali megjelenítési formában jól látszik a 104,5°-os vegyértékszög.
Fagyott állapotban a víz (jég) kristályos anyag. A baloldali molakulaképen a kristályában elhelyezkedő vízmolakulák láthatók huzalváz megjelenítésben.
Ionos anyagok oldódásakor a vízmolekulák a "megfelelő végükkel"
veszik körül az iont - a példában a negatív töltésü klorid iont a "pozitív
végükkel". (Jobbra az oldott kloridion térkitöltéses megjelenítésben.)
A Testoste.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
A víz a kémiai reakciók döntő többségében szerepel.
A hatalmas ipari vízigény jelzi, hogy a termelési folyamatokban is fontos
szerepet kap ez a vegyület. A vegyipar, a kohászat, a bányaipar stb. nagy mennyiségű
vizet használ fel és sajnos sok esetben jutnak szennyeződések természetes
vizeinkbe.
Poláris tulajdonsága miatt a víz a leggyakrabban használt oldószer.
Sok esetben jelenik meg reakcióközegként, az iparban éppúgy, mint az élő szervezetben
és a víz gyakori résztvevője a kémiai reakcióknak is.
A kémiai folyamatok
legnagyobb része vizes közegben zajlik és sok esetben részt is vesz a
reakcióban.
Így például a nátrium, higanykatódos eljárással
történő előállításakor a NaHg amalgámból vízzel választják le a higanyt.
A növényekben a fotoszintézis során a fény hatására szén-dioxidból és vízből keletkezik
a szőlőcukor:
6 CO2 + 6 H2O -> C6H12O6
+ 6 O2
A víz nem oldja az apoláros molekulájú vegyületeket.
Azonban a háztartásban sok olyan anyaggal találkozhatunk, melynek egyik összetevője
a víz és abban vannak eloszlatva más (pl. vízben nem oldódó
szerves) anyagok. Az ilyen rendszerek az úgynevezett kolloid
rendszerek, ahol a víz az úgynevezett diszperziós
közeg. Ilyen rendszer a tej vagy a paradicsomleves is.
A víz biokémiája
A víz az élet nélkülözhetetlen közege. Az összes életfolyamat
vizes közegben, oldatban
zajlik.
A fehérjéket vízburok
veszi körül. Az összes tápanyag, és felhasznált egyéb anyag vizes oldat
formában van jelen az élőlényekben. A növények és az állatok nagy része víz.
Az emberi szervezetnek is több mint 60%-át teszi ki ez a vegyület.
Hőháztartásunkban nagy párolgáshője (lásd fentebb) miatt kap szerepet, hiszen
1 g víz elpárologtatása bőrünkön keresztül 2 kJ energiát von el. Ezért
fázunk, amikor kilépünk a fűrdőkádból.
Nagy fajhője miatt az élő szervezetben lejátszódó exoterm kémiai reakcióknál
megakadályozza a hőmérsékletemelkedést.
Az élő szervezetben a víz minden arcát megmutatja. Reakcióközegként,
oldószerként, diszperziós
közegként (pl. vér) és a reakciók
résztvevőjeként nélkülözhetetlen kelléke számos anyagcserereakciónak, pl. fotoszintézis
, légzés.
A víz előfordulása
A világűrben is előfordul a víz, számtalan helyen találtak vízmolekulákat
a csillagközi térben,
gázfelhőkben. Jég formájában sikerült rábukkanni a Jupiter
egyik holdján, az Európán
(1997. április), a Merkúron
és a Lunar Prospector űrszonda
segítségével a Holdon
(1998. március) is. Vízjég található az üstökösökön is.
A Föld vízkészlete
nagyrészt folyadékállapotban
van tengervíz és édesvíz formájában.
Ezekben oldott anyagok
(sók) is jelen vannak.
Kémiailag tiszta vizet desztillációval
lehet előállítani, ezt desztillált víznek nevezzük.
 A Földön található vízkészlet
endogén eredetű. A jelenleg működő vulkánok
gázai és gőzei is nagy mennyiségben tartalmaznak vízgőzt.
A Földön található vízkészlet
endogén eredetű. A jelenleg működő vulkánok
gázai és gőzei is nagy mennyiségben tartalmaznak vízgőzt.
A 4,6 milliárd éves Föld
korai állapota erőteljesen különbözött a mai állapotoktól. A magas hőmérséklet
miatt az őslégkör
tartalmazta - gőz állapotban
- a Föld vízkészletének
döntő hányadát. A folyékony
halmazállapotú víz az őslégkörből
alakult ki. A hőmérséklet
csökkenése miatt megindult lecsapódási
folyamat hozta létre az ősóceánt.
Később a további hőmérséklet
csökkenés hatására egyre több víz került a földfelszínre, kialakultak
az óceánok, a tengerek,
a folyók és a tavak,
melyek egy része a mélybe szivárgott, azaz felszín
alatti vizekké változott.
A litoszféra is
nagymennyiségű kötött vizet tartalmaz.
A Föld vízkészletének
legnagyobb részét az óceánok
és tengerek teszik
ki, de érdekes hogy második helyen a kőzetekben
megkötött vizek állnak, amelyek csak a vulkáni
tevékenység segítségével szabadulhatnak fel. Jelentős mennyiségű még a szárazföldek
és az óceánok felszínén
felhalmozódott jég mennyisége is. A kőzetek
repedéseiben, a szárazföldeken és a légkörben
jelenlévő felszíni vizek mennyisége az előbbiekhez képest szinte elhanyagolható.
A Föld vízkészletének eloszlása
| Tároló közeg |
Mennyiség
|
| 103 km3-ben |
az össz víztömeg %-ában |
|
|
253 900
8 060
1348 000
27 820
125
100
1.25
1.13
12.3
|
15.5
0.5
82.3
1.69
-
0.01
-
0.00006
0.0008
|
| Összesen |
~1 638 020 km3
|
~100.0 %
|
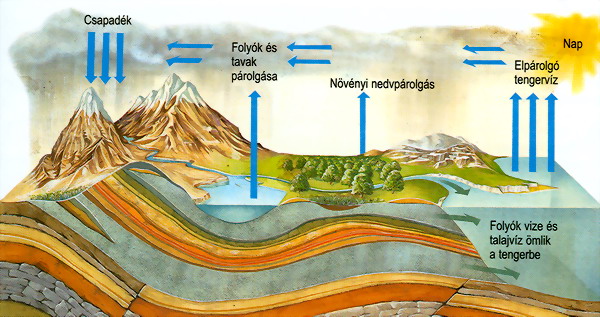
A víz körforgásában résztvevő vizeket vadózus vizeknek
nevezzük. Ezek legnagyobbrészt az őslégkörből
lecsapódott vizeket jelentik (tengerek,
óceánok, a folyók
és a tavak). Az endogén folyamatok azonban napjainkban is juttatnak vizet
a légkörbe. A vulkáni
folyamatok által légkörbe
került, mélységi eredetű, a víz körforgásában még nem résztvevő vizeket
juvenilis vizeknek nevezzük. A juveniles vizek a vulkáni
működésből, a mélyben levő olvadt kőzetanyagból
erednek.
A víz körforgása a természetben
Felhasznált irodalom
 Bár földünk
kétharmadát víz (H2O) borítja, testünknek is körülbelül kétharmada
víz, tehát szinte mindenütt jelen van környezetünkben (a képen például
mindenféle halmazállapotában megtalálható), mégis egy igazán különleges
anyagról van szó.
Bár földünk
kétharmadát víz (H2O) borítja, testünknek is körülbelül kétharmada
víz, tehát szinte mindenütt jelen van környezetünkben (a képen például
mindenféle halmazállapotában megtalálható), mégis egy igazán különleges
anyagról van szó. 



 Egyes vízi élőlények a
Egyes vízi élőlények a 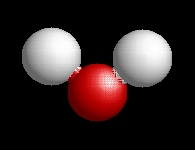

 A
A 