Név:
A latin carbon = szén
Név:
A latin carbon = szénszén / C
(carbon, korom, lángkorom, gázkorom, szénkörforgás)
 Név:
A latin carbon = szén
Név:
A latin carbon = szén
Rendszám: a periódusos rendszer 6. eleme
Felfedezés:
Ősidők óta ismert, meglehetősen tiszta szén a faszén.
A gyémánt (a képen) és a grafit
szintén nagyon régóta ismert, de csak a XVIII. század végén mutatták ki, hogy
a szén két allotrop
módosulata.
A harmadik allotrop
módosulatot, a fulleréneket 1985-ben fedezték fel.
Relatív atomtömeg:
12,011.
(A 12C: izotóp atomtömegéből - 12,0000 - származtatják az atomi
tömegegység definícióját!)
Izotópjai:
Stabil - a 12C (98,89%) és a 13C (1,11%).
10 féle radioaktív izotópja
létezik.
A 14C izotóp fontos
szerepet játszik a szénvegyületek kormeghatározásában.
Elektronkonfiguráció: [He](2s)2(2p)2
Fizikai tulajdonságok:
Három eltérő allotrop
módosulata van: a gyémánt, a grafit
és a fullerének.
A legtöbb oldószerben oldhatatlan, csak néhány fém
olvadékában oldódik.
Az úgynevezett amorf
szén valójában igen apró szemcséjű és rendezetlen rácsú grafit,
ehhez hasonló a koksz
is.
Közönséges hőmérsékleten a grafit a stabilis.
A gyémánt grafittá
alakulásának reakciósebessége azonban szobahőmérsékleten olyan csekély, hogy végtelennek
tekinthető, vagyis a gyémánt ilyen körülmények
között metastabilis.
Kémiai tulajdonságok:
Nemfémes elem.
Szagtalan, íztelen.
Oxidációs száma változó.
Ionokat nem alkot, vegyületeiben
kovalens kötésű.
Az elemi szén kevéssé aktív, csak a fluor
reagál vele közvetlenül szén-tetrafluorid képződése közben.
Oxigénnel csak magasabb hőmérsékleten
egyesül, szén-dioxiddá
ég el.
C + O2 = CO2
Oxigénszegény környezetben szén-monoxid keletkezik
2C + O2 = 2CO
Kénnel vörösizzáson szén-diszulfidot ad.
Nitrogénnel az elektromos ív hőmérsékletén
ciánná (CN2) egyesül.
Igen magas hőmérsékleten sziliciummal,
illetve bórral a megfelelő karbidokat adja.
Vízgőzzel is reagál, ennek részletei a hidrogénnél
találhatók.
Sok fémoxidot redukál,
fémek (pl. vas)
előállításánál használják. Ezek az adott fémnél
kerülnek említésre.
Külső héján 4 elektron
van ezt már elég nehéz akár leadni, akár kiegészíteni. A szénatom
külső elektronjai
azonban minden más atomtól
eltérően viselkednek. Ennek köszönhető az élet létezése.
A szénvegyületek
(szervesvegyületek)
száma többszöröse, mint az összes többi elemből
álló szervetlen vegyületek
száma összesen. Ennek oka, hogy a szénatomok
önmagukkal is képesek kapcsolódni a vegyületekben,
láncokat (pl. dekán), gyűrűket
(pl. benzol), vagy elágazásokat (pl.
2,3-dimetil-bután) képezve. Ez a tulajdonság
a szén-szén kötés nagy energiájának köszönhető. Ezek a kötések
még nagy atomszám esetén is elegendően stabilak. így más elemekkel
együtt sok millió különböző vegyületet
képezhetnek. Ezen kívül egymással kettős
(pl. etilén), sőt hármas
kötést is (pl. acetilén) képezhetnek.
A szén vegyületek közül nagyon sok, csoportosítva, külön részletesen megtalálható: alkánok, alkének, alkinek, alkoholok, aldehidek, karbonsavak, cikloalkánok, aromások, amidok, aminok, észterek, éterek, ketonok, aminosavak, stb. (A Szójegyzékben a keresőmezőbe a "szervesvegyületek" keresőszót beírva többszáz szénvegyületet találhat. Beírható persze az "alkánok", "alkének", stb. is ekkor - értelemszerűen - az összes alkán, alkén, stb. címszava legyűjthető. Természetesen ezek mindegyike megtalálható a Kislexikon tartalomjegyzékében névsor szerint, illetve a Kémia rész tartalomjegyzékében a megfelelő témakörnél.)
Előfordulás:
Elemi állapotban és kötött formában egyaránt előfordul. A legtöbb szén
kötött formában, karbonát-ásványként
található. Gyakori, pl.a mészkő,
és az aragonit
mindkettő (CaCO3), magnezit
(MgCO3), dolomit [CaMg(CO3)2], sziderit
(FeCO3), stb.
A természetes szén csaknem mind szerves eredetű, az ásványi vagyis a
kőszén nem elemi szén,
hanem bonyolult szénvegyületek keveréke.
A gyémánt eruptív közetekben fordul
elő, a Föld belsejéből
jut a felszínre.
Nagy mennyiségben találhatók szénhidrogén-vegyületek
a kőolajban és a földgázban.
A fölgázban és a
légkörben nagy mennyiségben található szén-dioxid.
Magyarországon Répcelak környékén csaknem tiszta szén-dioxidot
tartalmazó gáz tör
fel, amit szifonpatron töltésére fel is használnak.
Előállítás:
A szénvegyületek hevítve szén hátrahagyásával bomlanak, az így
kapott szén sokszor tartalmaz még kevés oxigént.
Az acetilén elektromos
szikra hatására szénre és hidrogénre
esik szét:
C2H2 = 2 C + H2
Szénvegyületek égésekor,
nem megfelelő mennyiségű oxigén jelenléte
esetén gyakran keletkezik korom, ami nagyon finom eloszlású (mikrokristályos)
szénrészecskékből
áll. Ez tüzelő berendezésekben, gépjárművekben káros jelenség, ugyanakkor "szándékosan"
állítanak elő, elsősorban a gumiipar
számára rengeteg kormot (gázkorom, lángkorom) földgázból.
Fekete pigmentként
is használják.
A szén-dioxid erősen aktív fémekkel
szénné redukálható:
CO2 + 2 Mg = C + 2 MgO.
Az alábbi képeken a reakció kísérleti megvalósítása látható:
| A magnézium meggyújtása szárazjégen | Az égő magnézium lefedése szárazjéggel | A reakció folyamata | A reakció során magnézium-oxid és szén keletkezik |
 |
 |
 |
 |
A grafit egy részét is mesterségesen
állítják elő Acheson szerint szénből elektromos kemencében igen magas
hőmérsékleten SiO2
(kvarc) jelenlétében.
Felhasználása:
Gyémánt : ékszer, vágó- és csiszolóeszközök
Grafit : nagy szilárdságú, korrózióálló
tégelyek, kádak, zárócsatlakozók
Természetes szenek: energiahordozó
és vegyipari alapanyag
Aktív szenek: adszorpciós
anyagok
Vegyületeit szinte
mindenütt használjuk. Egyre nagyobb mennyiségben alkalmazzuk a legkülönfélébb
műanyagokat, amelyek mind szerves
polimerek.
Az egyes vegyületeknél külön említésre kerül az adott vegyület felhasználása.
Biológia:
Az élő szervezeteket felépítő szerves
anyagok fő alkotórésze. Az élet legfontosabb alkotóeleme.
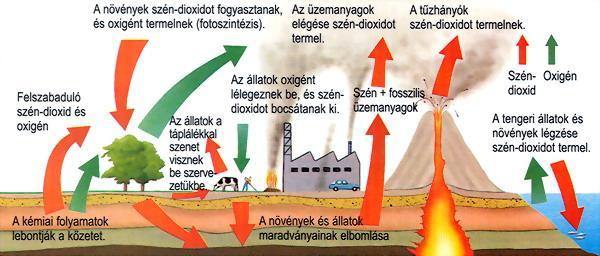
A szén körforgása a természetben