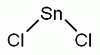
 SnCl2
SnCl2
Az ón klórral alkotott sója.
ón(II)-klorid
(sztanno-klorid)
 SnCl2
SnCl2
Az ón klórral
alkotott sója.
Előállítás
Fémes ón
és tömény sósav reakciójával.
Vízmentesen száraz hidrogén-klorid gáz és ón egymásrahatásával keletkezik:
Sn + 2 HCl = SnCl2 + H2
Savfeleslegnek kell jelen lennie, hogy a bázikus só kicsapódását megakadályozza.
Oldatának bepárlásával dihidrát (SnCl2 . 2 H2O) alakban
válik ki.
Klorid feleslegében piramisos [SnCl3]- keletkezik.
 Fizikai
és kémiai tulajdonságok
Fizikai
és kémiai tulajdonságok
Fehér kristályos
anyag (SnCl2 . 2 H2O)
Olvadáspontja: (vízmentes)
246°C, (dihidrát) 37,7°C
Forráspontja: (vízmentes) 652°C-on
Sűrűsége: (vízmentes) 3,95; (dihidrát) 2,71
g/cm3
Kristályos (dihidrát)
állapotban stabil.
Vízben oldódik,
de híg vizes oldatban,
különösen melegen hidrolizál,
oldhatatlan bázisos sót
képezve:
SnCl2 + H2O <-> Sn(OH)Cl + HCl
Sósav hozzáadásával az egyensúly a baloldal felé tolódik.
Oldata a levegőn is instabil:
6 SnCl2 + 2 H2O + O2 <-> 2 SnCl4 + 4 Sn(OH)Cl
A gázfázisban az SnCl2 molekula hajlított.
Savas oldatokban redukálószer, levegőn lassan oxidálódik:
Sn2+ → Sn4+ + 2e
Felhasználás
Savas oldatban
elterjedten (laboratóriumban) is használt redukálószer.
Oldatából (kevés sósavval
elegyítve) galvanizálással
ónbevonatot készítenek.
Vízmentes formában az ón
speciális vegyületeinek
előállítására.
Textil festésénél pácolószerként. Élénkebb színeket eredményez.
Biológia
Lenyelve hasi fájdalmat, hasmenést, hányingert, hányás okoz.
Belélegezve köhögést torokfájást okoz.
Szembe kerülve vörösséget, fájdalmat, okoz.