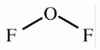
 Fluor-monoxid
Fluor-monoxid
F2O
Oxigén-fluoridnak is nevezik.
halogén-oxidok
(fluor-monoxid, oxigén-fluorid, klór-monoxid, diklór-oxid, klór-dioxid, jód-pentoxid, jód(V)-oxid)
Kovalens kötésű, alacsony forráspontú, molekulavegyületek.
Nem túl stabilak mivel az oxigén és a halogének elektronegativitásának különbsége
kicsi.
Vízzel halogén-oxosavakká alakulnak, azok az oxosavak, melyekben a halogén oxidációs száma +1, vagy+3 igen bomlékonyak, de sóik (halogenátok) stabilabbak.
Minden halogénnek több oxidja létezik, alább részletesebb információ található
a következőkről:
Fluor-monoxid, klór-monoxid, klór-dioxid, jód-pentoxid.
 Fluor-monoxid
Fluor-monoxid
F2O
Oxigén-fluoridnak is nevezik.
Előállítás
Nátrium-hidroxid híg (2%-os) oldatán fluort átbuborékoltatva
2 NaOH + 2 F2 = F2O + NaF + H2O
Fizikai és kémiai tulajdonságai
Színtelen gáz.
Magasabb hőmérsékleten bomlik.
Biológia
A légzőszerveket megtámadja
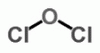 Klór-monoxid (diklór-oxid)
Klór-monoxid (diklór-oxid)
Cl2O
Előállítás
Száraz higany(II)-oxid és klór egymásra hatásával:
HgO + 2 Cl2 = Cl2O + HgCl2O
Fizikai és kémiai tulajdonságai
Sárgásbarna, narancs színű gáz.
Igen bomlékony.
Vízzel hipoklóros-savat ad, tehát ennek a savnak az anhidridje.
Alkáli- és földalkáli-hidroxidokkal megfelelő hipokloritokká egyesül.
Erős oxidálószer.
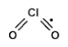 Klór-dioxid
Klór-dioxid
ClO2
Előállítás
A nagy reakcióképessége miatt a legkedvezőbb előállítása a nátrium-klorátnak nedves oxálsavval történő reakciója 90-100°C-on, mivel a terméket ilyenkor hígítja a felszabaduló szén-dioxid.
Az iparban kloridionokat tartalmazó kénsavat reagáltatnak kén-dioxiddal.
Klórsavból tömény kénsav hatására keletkezik:
3 HCLO3 = 2 ClO2 + HClO4 + H2O
Fizikai és kémiai tulajdonságai
Sárgávörös, könnyen cseppfolyósítható gáz.
Sűrűsége 3,09 g/cm3
Olvadáspontja -59,5°C
Forráspontja 9,9°C
Könnyen bomlik, sőt
akár robbanhat is.
Meleg vízben
klór(VII)-savra, kloridra és oxigénre bomlik.
Igen erős oxidálószer.
Alkálifém-hidroxidokkal klorát és klorit keletkezik belőle:
3 ClO2 + 2 NaOH = NaClO3 + NaClO2 + H2O
 Felhasználás
Felhasználás
Széles körben használják fehérítésre a liszt őrlésénél.
Faanyagok feldolgozásánál.
Oldatát ivóvíz fertőtlenítésére használják víztisztítási folyamatokban.
 Jód-pentoxid
(jód(V)-oxid)
Jód-pentoxid
(jód(V)-oxid)
I2O5
Előállítás
Jódsavból állítható elő 250°C-os levegőáram hatására.
Fizikai és kémiai tulajdonságai
Színtelen kristályokból
áll.
Sűrűsége 4,799 g/cm3
300-350°C-on bomlik
Vízben oldva
jód(V)savat ad, erős oxidálószer.
A szén-monoxidot pl. szén-dioxiddá
oxidálja jód
kiválása közben:
5 CO + I2O5 = 5 CO2 + I2