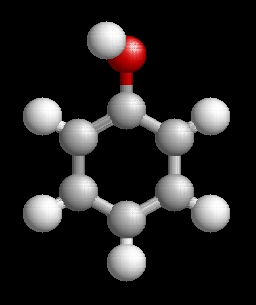
Egy- és töbértékű fenolok, illetve származékaik molekulaképei:
(A nyilakkal válthatja a molekulaképeket.)
egy- és többértékű fenolok
Fenoloknak nevezzük azokat az aromás
vegyületeket, amelyek aromás gyűrűjében
egy vagy több hidrogént hidroxil
csoport (OH) helyettesít.
Az egy hidroxil csoportot
tartalmazó vegyületek az egyértékű fenolok, a több hidroxil csoportot tartalmazók
a többértékű fenolok.
 |
Egy- és töbértékű fenolok, illetve származékaik molekulaképei: (A nyilakkal válthatja a molekulaképeket.) |
Ha a hidroxil csoport az oldallánc hidrogénjét helyettesíti akkor aromás alkoholról beszélünk.
Előállítás
a) Fenolok nyerhetők aromás szénhidrogének halogenidjeiből megfelelő körülmények között hidrolizálva, pl. 8%-os nátronlúggal autoklávban rézsók jelenlétében hevítve. Ezt az eljárást ipari méretekben alkalmazzák. Ha a kicserélendő halogénatom mellett az aromás magban nitrogyök van a kicserélés gyorsabban megy.
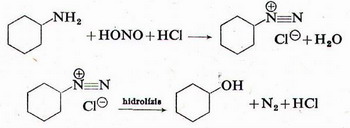
b) Primer aromás aminokból salétromsavval erős sav jelenlétében diazóniumsót kapunk, amely melegítve nitrogénfejlődés közben fenollá alakul:
Fizikai és kémiai sajátságok
A fenolok kristályos
könnyen olvadó vegyületek.
Nagyon gyenge savak,
oldatuk vezetőképessége kicsi.
Lúgokkal fenolátokat
adnak.
A hidroxil csoport hidrogénjét alkillal
lehet helyettesíteni, így éterek keletkeznek,
pl.:
C6H5Na + IC2H5 -> C6H5+C2H5 + NaI
Sav-kloridokkal észterek keletkeznek:
C6H5OH + CLOC-CH3 -> C6H5OO-CH3 + HCl
Foszfor-pentakloriddal kór-benzol keletkezik.
Hidrogénnel gőzfázisban magas hőmérsékleten benzollá, illetve megfelelő aromás szénhidrogénné redukálódnak.
Vas(III)-kloriddal a fenolok vizes oldata ibolyára színeződik.
Brómvízzel tribróm-fenol válik ki csapadék
alakjában.
Már híg salétromsav
hatására nitro-fenolok képződnek.
Hidrogén-peroxiddal az kétérékű fenolok képződnek.
Az egyértékű fenolok közül fenollal
és a krezollal, a több értékű fenolok
közül a dioxi-benzolokkal és származékaikkal
(gvajakol, eugenol,
pirogallol) részletesebben, külön foglalkozom.