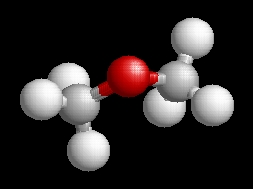
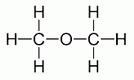
C2H6O, CH3-O-CH3
éterek
(egyszerű éter, vegyes éter, Williamson-szintézis,
dimetiléter, metoxi-metán, faéter, etiléter, dietiléter, etoxi-etán)
Oxigénnek két alkil-gyökkel
alkotott vegyületei.
C-O-C funkciós csoportot tartalmaznak.
Ha a két alkil-gyök
azonos, egyszerű éternek, ha különböző vegyes éternek nevezik.
Elnevezés
- Az étereket általában a bennük lévő csoportok alapján nevezik el.
Pédául a két metil-csoportot
tartalmazó egyszerű éter esetén dimetil éter, vagy az egy metil-
és egy etil-csoportot
tartalmazó vegyes éter esetén metil-etil-éter.
- Az IUPAC elnevezés ugyanennél a két vegyületnél metoxi-metán, illetve
metoxi-etán.
Fizikai és kémiai tulajdonságok
A dimetiléter gáz.
A dietilétertől kezdve folyadékok,
amelyek forráspontja
a molekulatömeggel növekszik.
Minden dialkil-éter forráspontja
lényegesen alacsonyabb, mint a megfelelő alkoholé,
mert nem asszociálnak (nincs nennük hidroxilgyök, mint az alkoholokban.)
Kémiailag igen állandóak, stabilabbak az alkoholoknál.
Nátriummal nem reagálnak.
Alkáliák nem hatnak rájuk.
Savakkal főzve hidrolizálnak.
Hidrogén-jodid már hidegen is albontja őket alkil-jodidra és alkoholra:
CnH2n+1OCnH2n+1 + HI -> CnH2n+1OH + CnH2n+1I
Magasabb hőmérsékleten csak alkil-jodid keletkezik.
Hidrogén-kloriddal és más vegyületekkel addíciós vegyületeket alkotnak, pl.
C2H5OC2H5.HI, stb.
Az ilyen képletű vegyületek oxóniumsók, tehát koordinációs
vegyületek.
Előállítás
- Nátrium-alkoholátból alkil-jodiddal
(Williamson-szintézis):
C3H7ONa + ICH3 -> C3H7OCH3 + NaI
Ezzel a módszerrel egyszerű és vegyes éterek egyaránt szintetizálhatók.
- Egyszerű éterek előállíthatók alkil-halogenidből ezüst-oxiddal:
2 C4H9I + Ag2O -> C4H9OC4H9 + 2 AgI
- Etilétert és más étereket egészen amiléterig elő lehet
állítani a megfelelő alkoholból tömény
kénsavas vízelvonással
(Williamson-szintézis).
A reakció két lépésben megy végbe:
C2H5OH + HOSO2OH -> C2H5OSO2OH
+ H2O
C2H5OH + C2H5OSO2OH ->
+ C2H5OC2H5 + HOSO2OH
Ha a reakció második fázisában az elsőtől eltérő alkoholt adnak az elegyhez, akkor vegyes éter keletkezik, ami igazolja a fenti reakció lefolyást.
Dimetiléter (metoxi-metán, faéter)

|
C2H6O, CH3-O-CH3
|
Előállítás
Metilalkoholból tömény kénsavval vagy foszforsavval.
Fizikai és kémiai tulajdonságok
Közönséges hőmérsékleten gáz.
Színtelen, éterszagú.
Olvadáspontja -41°C
Forráspontja -23,6°C
 Felhasználás
Felhasználás
Más anyagokkal együtt oldószerként alkalmazzák, (pl. aeroszolos festék, purhab).
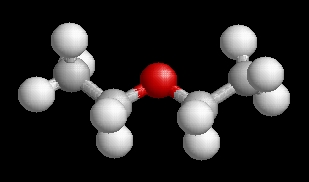
(Di)etiléter (etoxi-etán)
|
C4H10O, C2H5-O-C2H5
|
Előállítás
Etilalkoholból tömény kénsavval (a reakció fentebb látható).
Fizikai és kémiai tulajdonságok
Színtelen, éterszagú, könnyen mozgó folyadék.
Olvadáspontja -116,3 °C
Forráspontja 34,6°C
Vízben kissé oldódik és maga is old kb. 3% vizet.
Sok szerves és szervetlen
molekulavegyületettet
nagyon jól old. A vizes oldat
éterrel összerázva átadja az éterben jól oldódó anyagot az éteres
fázisnak ("kiéterezés").
A nitrocellulóz is oldódik éter-alkohol elegyben, így keletkezik az úgynevezett
kollódium, amelyből Chardonnet az első műselymet állította elő.
Oxigén hatására robbanékony peroxidok képződhetnek belőle.
 Felhasználás
Felhasználás
Oldószerként.
Az orvosi gyakorlatban érzéstelenítésre és sok más célra.
Lexikonom összes éterekkel kapcsolatos címszava legyűjthető a Szójegyzék
kereső mezőjébe beírva az éterek keresőszót.