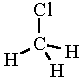
 metil-klorid
metil-klorid
(klórmetán)
CH3Cl,
alkil-halogenidek
(haloalkánok, freonok, Wurtz reakció, Fitting reakció, Grignard reakció, metil-klorid, klórmetán, metil-jodid,
jódmetán, etil-klorid, klóretán, etil-jodid, jódetán)
A paraffin szénhidrogénekből egy hidrogént halogénnel helyettesítve keletkező halogénezett szénhidrogén vegyületek.
Fizikai és kémiai tulajdonságok
A metil-, etil-, propil-, izo-propil- és izo-butil-fluorid, valamint a metil-,
etil-klorid, közönséges hőmérsékleten
gáz.
A következők folyékonyak.
A nagy szénatomszámúak közönséges hőmérsékleten
is szilárdak.
Valemennyi szintelen, de fény
hatására a jodidok könnyen elszíneződnek.
Szaguk édeskés, meggyújtva zöld szegélyű lánggal égnek.
Vízben alig oldhatók,
alkohollal és éterrel
azonban minden arányban keverednek.
Ezüst-nitráttal szobahőmérsékleten
lassan, melegítve gyorsan kiválik a megfelelő ezüst-halogenid.
Nátriummal melegítve éteres
oldatban a Wurtz reakció megy végbe:
2 C2H5I + 2 Na = 2 NaI + C4H10 (n-bután)
Az analóg reakció az alkil-halogenidek és az aril-halogenidek reakciója:
C6H5Cl + CH3Cl + 2Na → 2NaCl + C6H5CH3
amit Fitting reakciónak neveznek, Rudolph Fitting (1835-1910) német kémikus után.
Cinkkel cink-dialkil keletkezik, pl.
2 Zn + 2 C2H5I = Zn(C2H5)2 + ZnI2
Alkil-klorid brómmal és vasforgáccsal kezelve a megfelelő bromiddá alakul; kloridok és bromidok nátrium-jodiddal a megfelelő jodiddá, stb.
Szerves szintézis szempontjából fontos reakció játszódik le az alkil-bromidok és -jodidok abszolút éteres oldatában fémmagnéziummal (Grignard reakció):
C3H7I + Mg = C3H7MgI (propil-magnézium-jodid)
Klórozott termékek kevésbé reagálnak, de kisebb szénatomszámúaknál
még megy az alkil-magnézium-klorid képződése.
Az így kapott úgynevezett Grignard-reagensek rendkívül reakcióképes anyagok.
Az alkil-fluoridok gázok, kék lánggal égnek, mérgezőek.
Előállítás
Olefin(telítetlen)-szénhidrogénekből
halogénhidrid addícióval (elektrofil addícióval):
H2C=CH2 + HBr = H3C-CH2Br
Alkoholokból halogén-hidriddel:
C H3OH + HCl = C H3Cl + H2O
 metil-klorid
metil-klorid
(klórmetán)
CH3Cl,
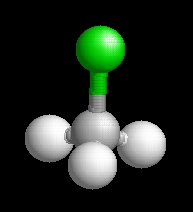
A metil-klorid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|

|
A MetiKlor.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Metanol és sósav
reakciójával állítható elő, továbbá cukorrépa melasz erjesztésénél
a hátramaradó moslékból nyert betainból. Használják hűtőgépek
töltésére és szerves szintézisekhez.
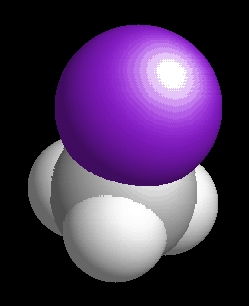
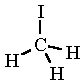 metil-jodid
metil-jodid
(jódmetán)
CH3I
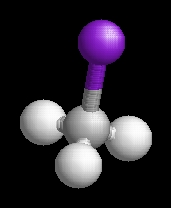
A metil-jodid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|
|
A MetiJodi.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Fizikai és kémiai tulajdonságok
Nagy sűrűségű, színtelen,
édeskés szagú folyadék.
Sűrűsége 2,28 g/cm3
Olvadáspontja -66,45°C
Forráspontja 32,4°C.
Előállítás
Metanolból jód
és vörös foszfor keverékével.
Szintézisekhez használatos.
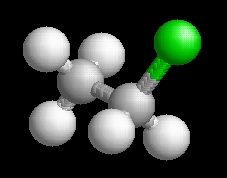
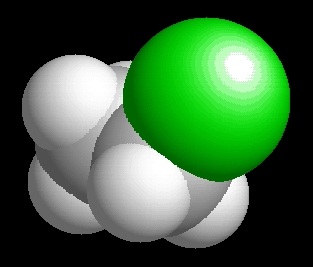
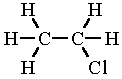 etil-klorid
etil-klorid
(klóretán)
C2H5Cl
Az etil-klorid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|
|
Az EtilKlor.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Fizikai és kémiai tulajdonságok
Színtelen, gyúlékony, könnyen cseppfolyósítható gáz.
Olvadáspontja -136,4°C
Forráspontja 12,3°C.
Előállítás
Metanolból jód és vörös foszfor keverékével.
Etén és hidrogén-klorid reakciójával.

Nyomás alatt kis palackban
hozzák forgalomba, amiből vékony sugárban kifújva az érzéstelenítendő testrészre
fecskendezhető, ahol erős lehűlést okoz.
Régebben
ólom-tetraetil gyártására használták.
Szintézisekhez használatos.
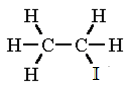 etil-jodid
etil-jodid
(jódetán)
C2H5I
Fizikai és kémiai tulajdonságok
Színtelen folyadék.
Sűrűsége 1,9 g/cm3
Olvadáspontja -108°C
Forráspontja 72°C.
Előállítás
Etanolból jód
és vörös foszfor keverékével.