Erők a molekulák világában
A léggömb titkának magyarázata
Miért kezdett dagadni a levegővel töltött gumigömb, amikor üvegburával leborítottuk?
Miért pukkant szét?
A kísérletet valóban bűvész módra végeztük el. Az asztallapon egy kis nyílás
volt. Amikor a gumigömböt az üvegbura alá tettük, észrevétlenül egy csapot fordítottunk
el és világítógázt eresztettünk az üvegbura alá. Ezután kezdett dagadni a gömb
(ábra).
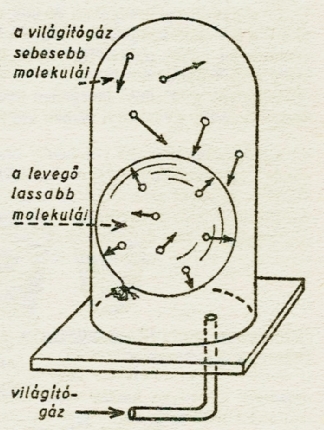 De miért? Hiszen a gömb szája be volt kötve, a gömbbe nem mehetett be se levegő,
se világítógáz!
De miért? Hiszen a gömb szája be volt kötve, a gömbbe nem mehetett be se levegő,
se világítógáz!
Valóban, a gömb száján át nem ment be semmi. Ámde a gömbön kívül világítógáz-molekulák
röpködtek. Tudnunk kell azt, hogy a világítógáz könnyebb, mint a levegő. A könnyebb
gázok legapróbb részecskéi: atomjai, molekulái pedig sebesebben röpködnek, mint
a nehezebb gázok molekulái. A gumihártya molekulái között parányi hézagok vannak.
Ezeken a réseken át a világítógáz sebesebben szálló molekulái közül több jut
be másodpercenként a gömbbe, mint amennyi levegőmolekula távozik belőle.
Ezért duzzad állandóan a gömb, végül elpattan.
Miért duzzad elpukkanásig a világítógázban levő, levegővel töltött gumigömb?
Hasonlóképpen lehet megmagyarázni azt is, hogy a szőlőszem megduzzad és megreped,
ha tiszta vízbe tesszük.
A szőlőszem héját alkotó hártyának az a tulajdonsága, hogy csak bizonyos folyadékok
molekuláit ereszti
át magán, például a vízét.
De a vízmolekulákat is
csak akkor ereszti át magán, ha a hártya másik oldalán például cukoroldat
van. A szőlőszemben levő folyadékban
mindig van oldott cukor.
Ezért a szőlőszemen kívül levő víz
molekulái a szőlőhéjon
át behatolnak a szőlőszembe - a szőlőszem egyre duzzad.
De tegyük a szőlőszemet töményebb cukoroldatba,
mint amilyen a szőlőszemben van. Most meg a szőlőszem belsejéből jönnek át a
vízmolekulák a cukrosabb,
külső oldat felé, végül
is annyi vizet veszít a
szőlőszem, hogy összetöpörödik. - Az olyan tulajdonságú hártyát, mint a szőlőszem
héja, féligáteresztő hártyának nevezzük.
Mekkorák a molekulák és milyen közel vannak egymáshoz?
Földünk lakóinak száma
körülbelül 3000 millió (3 milliárd). (Jelenleg már több mint 6 milliárd)
Képzeljünk el annyi levegőt, amennyi belefér egy nagyobbfajta gyűszűbe (kb.
5 cm3). A gyűszűben kb. 40 000 milliószor több molekula van, mint a Föld lakosainak
száma (ábra).
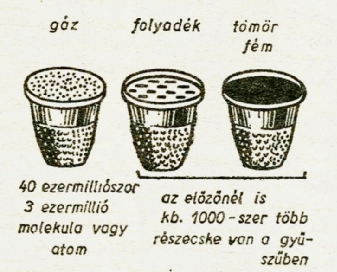 Ha a gyűszűnyi
levegőben 40 000 milliószor 3000 millió molekula van, akkor a molekulák roppant
kicsinyek lehetnek. Egy milliméter távolságot osszunk fel millió részre. Egy
ilyen kis részecske tizedrésze kb. akkora, mint a molekulák átmérője.
Ha a gyűszűnyi
levegőben 40 000 milliószor 3000 millió molekula van, akkor a molekulák roppant
kicsinyek lehetnek. Egy milliméter távolságot osszunk fel millió részre. Egy
ilyen kis részecske tizedrésze kb. akkora, mint a molekulák átmérője.
De ha egy gyűszűnyi levegőben ilyen alig elképzelhetően sok molekula van, akkor
egy gyűszűnyi vízben vagy más folyadékban még többnek kell lennie, mert a folyadékokban
sűrűbben vannak, közelebb vannak egymáshoz a molekulák.
Így is van! Egy gyűszűnyi folyadékban
vagy szilárd anyagban körülbelül 1000-szer több molekula
van, mint egy gyűszűnyi levegőben.
A molekulák vonzzák egymást
A levegőben, általában a gázokban a molekulák olyan könnyen mozognak egymás
mellett, hogy elszállanak elszakadnak egymástól. A folyadékokban meg szépen
megmaradnak egymás társaságában. Ha beöntjük őket egy pohárba, ott maradnak.
A szilárd anyagokat még pohárba sem kell önteni, a molekulák annyira ragaszkodnak
egymáshoz, hogy sokszor még erővel se tudjuk őket szétválasztani, például hiába
próbálunk kézzel eltörni egy acéldarabot.
Hogyan lehet ez? Hiszen ugyanazokról a molekulákról
van szó. Miért viselkednek egyszer olyan csapongóan, máskor meg miért maradnak
meg hűségesen egymás mellett?
Ennek oka az, hogy a molekulák
között is hat valamiféle vonzóerő. Ha igen közel vannak egymáshoz, akkor ez
a vonzóerő nagy lehet. De ha két molekula
egymástól 10 - 20-szor távolabb van, mint átmérőjük távolsága, akkor már úgyszólván
semmi ez a vonzóerő.
Ámde nagyon közel se lehet egymáshoz vinni a molekulákat
(pl. olyan közel, hogy érintkezzenek), mert akkor meg óriási taszítóerő hat
közöttük. Ezért állanak ellen a szilárd
és a cseppfolyós testek, ha össze akarjuk őket nyomni.
Milyen ez a molekulák között ható vonzóerő? Olyan talán, mint a mi nagyvilágunkban
a tömegvonzás? Nem olyan! Sejtjük, hogy az a molekuláris erő elektromos és mágneses
természetű, de még időre és tudományos kutatásra lesz szükség, hogy többet tudjunk
meg róla. Gondoljunk csak arra, hogy a kőkorszak embere sem ismerte például
sem az elektromos, sem a mágneses erőt, és ezer évekig tartott, amíg az ember
lassanként egyre többet tudott meg róluk.
A különböző anyagok molekulái is vonzzák egymást
A víz molekulái vonzzák egymást. Ezért marad egyben a vízcsepp.
 De ha vízcseppet
ejtünk üveglemezre, az üveglemez vizes felét lefelé fordíthatjuk, és a vízhártya
függve marad az üveglapon, mert a víz molekulái nagyobb erővel vonzódnak az
üvegmolekulákhoz, mint egymáshoz (ábra).
De ha vízcseppet
ejtünk üveglemezre, az üveglemez vizes felét lefelé fordíthatjuk, és a vízhártya
függve marad az üveglapon, mert a víz molekulái nagyobb erővel vonzódnak az
üvegmolekulákhoz, mint egymáshoz (ábra).
Higannyal már nem sikerül ez a kísérlet, mert a higany molekulái jobban vonzzák
egymást, mint az üvegmolekulákat.
A nikkel és a hidrogéngáz molekulái igen vonzódnak egymáshoz. Ennek következménye
az, hogy a gázmolekulák nemcsak a fém felületére tapadnak, hanem bejutnak a
fém belsejébe is, és olyan erősen odatapadnak más gázok is más fémek molekuláihoz,
hogy csak izzítással lehet őket eltávolítani.
Ez a jelenség sok gondot okozott a rádiócsövek, a röntgencsövek gyártóinak,
mert hiába szivattyúzták ki a csövekből a levegőt, az üvegre, az üvegbe és a
fémekbe tapadt gázrészecskék tönkretették a nagymértékben légritkított teret.
Az anyagok annál nagyobb számú idegen molekulát tudnak magukhoz láncolni, mennél
nagyobb az illető anyag felülete. Ha 1 gramm szenet finom porrá törünk, akkor
a szénrészecskék felülete 1000 cm2 lesz. Ezért egyetlen cm3 faszénpor vagy füstrészecske
sok cm3 másfajta anyag molekuláját tudja lekötni, elnyelni. Például 1 cm3 kiizzított
faszén 90 cm3 ammóniagázt nyel el.
Ezért van a szénpornak olyan nagy szerepe nemcsak a gyomortartalom tisztításában,
hanem az alkohol, a bor, a cukor színtelenítésében is:
a szén a felületére gyűjti, kivonja a folyadékból a nem kívánatos anyagok molekuláit.
A szénsavas víz. A halak és az oxigén
A szénsavas vizet
is a különböző anyagok molekuláinak
egymásra gyakorolt vonzóerejének köszönhetjük. A víz
molekulái vonzzák
a szén-dioxidgáz molekuláit,
a víz elnyeli a szén-dioxidgázt.
Például 1 liter 10°C hőmérsékletű víz
1,2 liter szén-dioxidgázt nyel el. De ha 25 atmoszférával nyomjuk a gázt, akkor
a víz 16-szor annyit nyel
el, mint közönségesen.
De azt már kevesen tudják, hogy a halak és a vízben
élő állatok milyen sokat köszönhetnek ennek a molekulák
közötti vonzóerőnek. - Már említettük, hogy a nikkelatomok
különösen a hidrogénmolekulákhoz
vonzódnak. A többi anyagok legkisebb részecskéi is válogatósak, így a víz
molekulái is.
A víz felülete a levegővel érintkezik. A levegőben a legnagyobb mennyiségben
nitrogén és oxigén van. Ha már most a vízmolekula egyformán vonzódna a nitrogén
és az oxigén molekuláihoz, akkor a vízben elnyelt levegőben is olyan arányban
(4 : 1) volna nitrogén és oxigén, mint a szabad levegőben. Csakhogy a vízmolekulák
nagyobb mértékben kötik magukhoz az oxigénmolekulákat. Ezért a vízben elnyelt
levegőben aránylag kétszer több oxigén van, mint a szabad légkörben. Ebből élnek
a halak.
Milyen gázok molekuláiból áll Földünk légköre?
| A légkörben
van (térfogatszázalékban) |
|
| 18,1% nitrogén,
ennek összes súlya |
3800 ezermillió tonna,
|
| 21% oxigén,
ennek összes súlya |
1170 ezermillió tonna,
|
| 0,94% argon,
ennek összes súlya |
131 ezermillió tonna,
|
| 0,03% szén-dioxid,
ennek összes súlya |
4,6 ezermillió tonna,
|
| 0,0012% neon,
ennek összes súlya |
0,084 ezermillió tonna,
|
| Összehasonlításul megemlítjük, hogy |
|
| a Föld
légkörének összes súlya |
5100 ezermillió tonna,
|
| a Földön
levő víz összes súlya |
125 000 ezermillió tonna,
|
a Földön
levő élőlények (szárazföldi és
vízinövények, állatok) összes súlya |
17 000 ezermillió tonna.
|
A szakítási szilárdság és a molekuláris erő
A molekulák közötti vonzóerővel sok tapasztalatunkat tudjuk magyarázni. Például
egy vékonyabb ólom drótot könnyen szétszakíthatunk, az alumínium drótot nehezebben,
az acél drót inkább kezünkbe vág, de nem szakad el. Miért?
Nagyon egyszerű. A szilárd testekben a molekulák olyan közel vannak egymáshoz,
hogy elég nagy a molekulákat egymáshoz kötő vonzóerő. Ha a testeket szét akarjuk
szakítani, akkor ezt az erőt le kell győzni. De mivel az ólom, az alumínium,
az acél esetén ennek a szakítóerőnek a nagysága más ás más, ebből arra következtetünk,
hagy a molekuláik között ható vonzóerő nagysága a különböző anyagok esetén más
ás más.
Huzalok szakítási szilárdsága
(1 cm2 keresztmetszetű huzal szétszakításához szükséges kilogrammsúlyerő)
| acélhuzal |
16000
|
| rézhuzal
(kemény) |
3 500
|
| alumíniumhuzal |
1 800
|
| ólomhuzal
|
160
|
| fapálca |
400
|
| kenderkötél |
400
|
| nylonkötél |
6000
|
| bőrszíj |
160-300
|
De miért beszélünk ólomról, acélról?
Igazán nem szoktunk naponta ilyen drótokat szaggatni. De naponta tépjük el pl.
a papírt. Nemrégiben olyan celofánpapír
került a kezembe, amit el sem tudtam tépni az első próbára. Milyen nehéz elszakítani
a nylonfonalat is!
Gondoljunk ilyenkor elismeréssel azokra a molekulákra,
amelyek a celofánpapírban,
a nylonszálban olyan
nagy erővel vonzzák egymást.
Miért nedvesítjük meg a postabélyeget?
Amikor szórakozottan felragasztjuk a levélbélyeget, ugyan ki gondol a molekuláris
erőre? Ha a bélyeg hátán nem lenne ragasztószer, hiába nyomnánk a bélyeget a
levélpapírra, molekuláik nem vonzzák egymást annyira, hogy szilárdan összetapadjanak.
De a ragasztószer molekulái erősen összekötik őket.
Méghozzá itt a különböző anyagok molekulái közötti összetartó erőről van szó.
De miért kell megnedvesíteni a bélyeg hátát? Miért csak a folyékony ragasztószer
köt?
Ha a ragasztószert megnedvesítjük, molekulái szétoszlanak a vízben (vagy egyéb
oldó folyadékban), a vízzel együtt könnyen belejutnak a papírfelület lyukacsaiba.
Így a ragasztószer molekulái nagy felületen tapadhatnak a papírfelület molekuláihoz.
Amikor a víz elpárolog, a ragasztószer molekulái nagy felületen fogják a papiros
molekuláit és természetesen egymást is, azért szilárdan összetartják a papírdarabokat.
Ha a bélyeget le akarjuk tépni a levélről, inkább a papír szakad el, mintsem
a ragasztószer engedjen. Tehát két papírdarabot a ragasztószer idegen molekuláinak
vonzása következtében szilárdabban Össze lehet erősíteni egymással, mint amekkora
a papiros eredeti szilárdsága.
Nem lehetne-e a bélyegragasztáshoz hasonlóan a fémeket is összeragasztani? Nem
lehetne-e például két acéllemezt úgy összeragasztani, hogy inkább a lemezek,
a fémdarabok törjenek, szakadjanak el egymástól, de a ragasztás helyén mégse
váljanak el egymástól a fémek? Vagy nem lehetne-e ilyen szilárdan összeragasztani
különböző lemezeket, rezet, acélt, alumíniumot? Mert bizony nehéz művelet a
fémek összeerősítése hegesztéssel vagy szegecseléssel.
Az eddigiek alapján semmi lehetetlenség sincsen a fémek összeragasztásában.
Csupán olyan ragasztószert kell találni, amelynek molekulái
egymást legalább akkora erővel
tartják össze, mint az acél molekulái,
másodszor pedig legalább ugyanekkora erővel kötik magukhoz az acél vagy más
fémek molekuláit
Is.
Ma mér valóban többféle ragasztószerrel folynak eredményes kísérletek a fémek
ragasztására. (Ma
már nagyon hatékony fémragasztók léteznek.)
Tapasztalatból tudjuk, hogy ha valamelyik ragasztószer
jól ragasztja a papirost, nem ragasztja ugyanolyan jól az üveget
vagy a porcelánt.
Most már ennek okát is értjük: hiszen egy bizonyos ragasztószer
molekulái csak meghatározott
más anyag vagy anyagok molekuláihoz
vonzódnak, tapadnak erősen a molekuláris erők révén.
Hogy a mindennapi élet egyszerűnek látszó, megszokott dolgaiban mennyi tudományos
érdekesség rejlik éppen a molekulákkal
kapcsolatban, azt a kővetkező fejezet is igazolja.
Felhasznált irodalom
 De miért? Hiszen a gömb szája be volt kötve, a gömbbe nem mehetett be se levegő,
se világítógáz!
De miért? Hiszen a gömb szája be volt kötve, a gömbbe nem mehetett be se levegő,
se világítógáz!  Ha a gyűszűnyi
levegőben 40 000 milliószor 3000 millió
Ha a gyűszűnyi
levegőben 40 000 milliószor 3000 millió  De ha
De ha